ნერვული მიკროგარემოს რემოდელირების თავისებურებები საშვილოსნოს ყელის ინტრაეპითელურ ნეოპლაზიასა და ბრტყელუჯრედოვან კარცინომაში
ჩამოტვირთვები
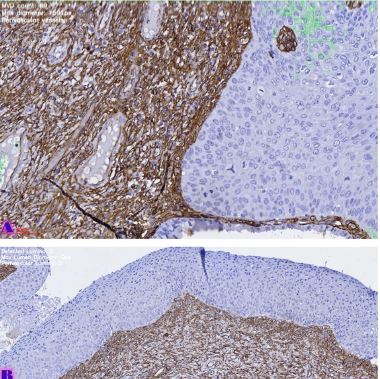
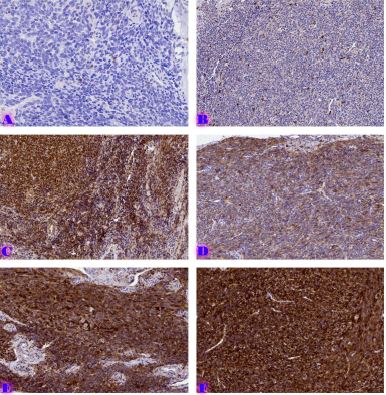
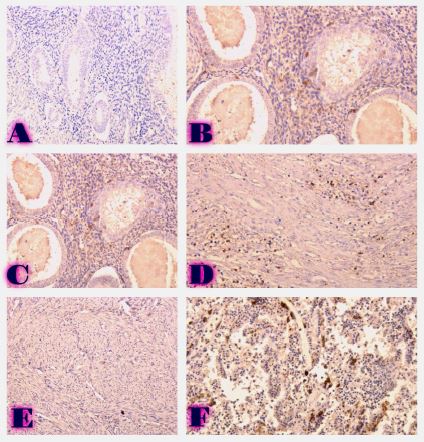
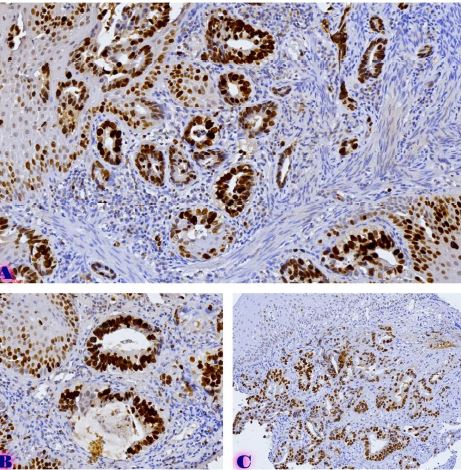
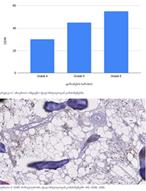
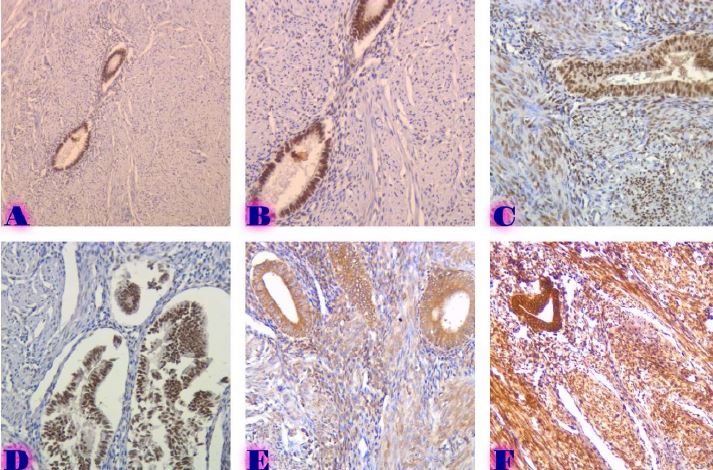
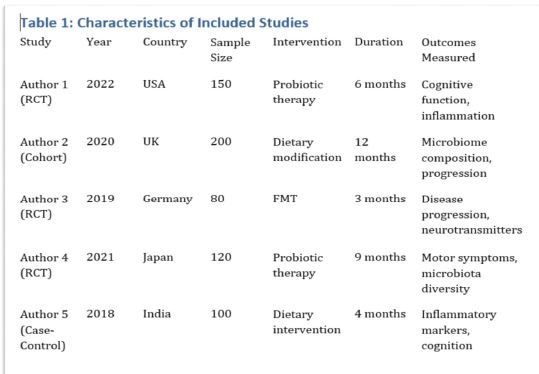
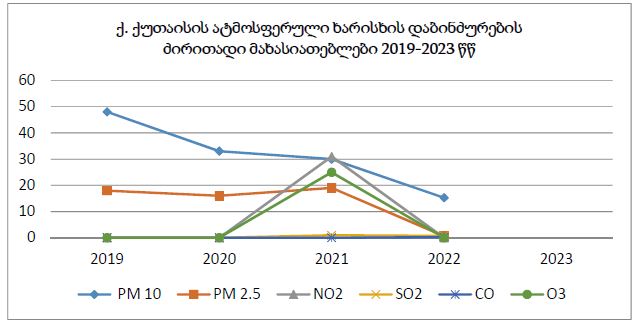
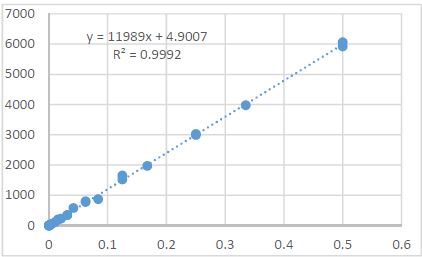
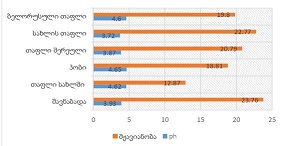
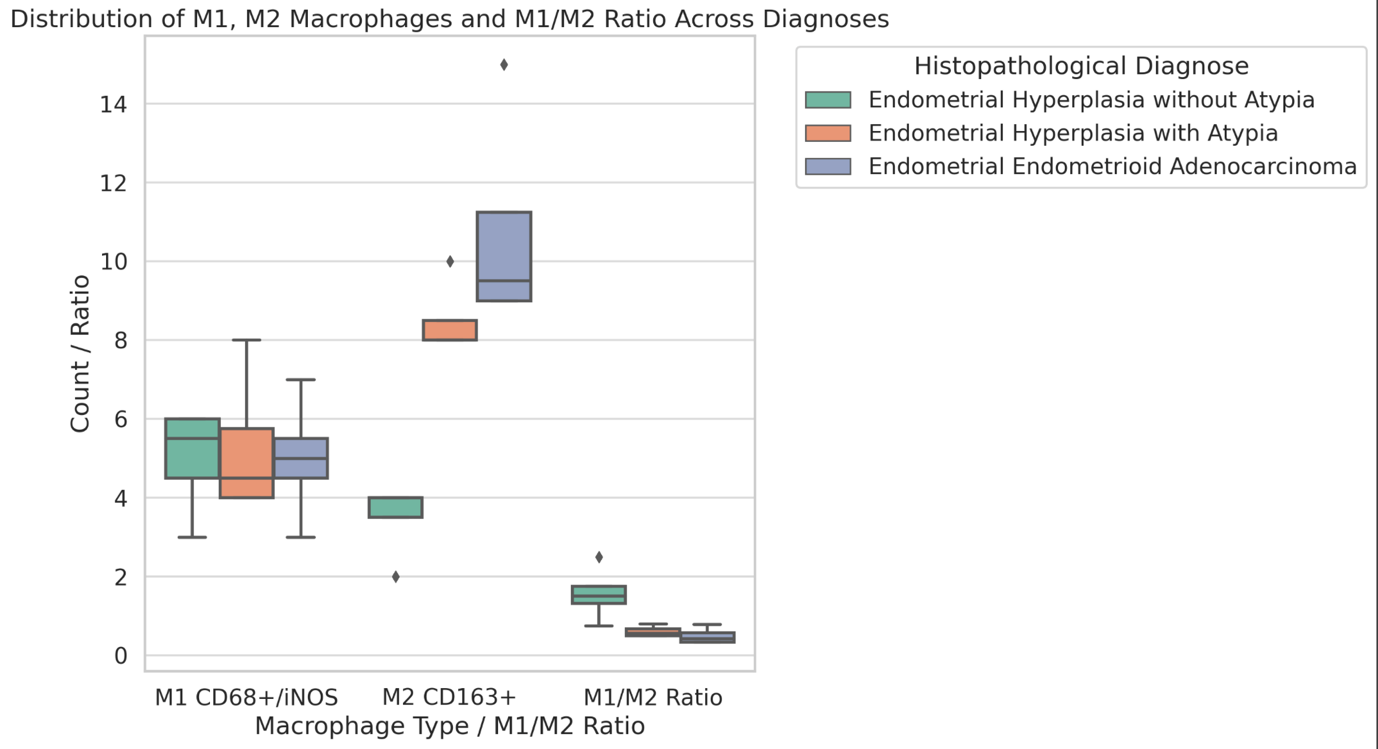
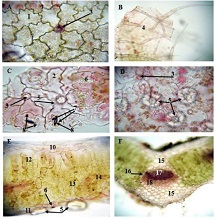
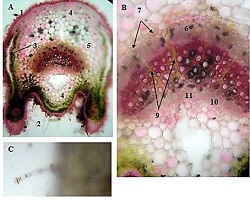
მიუხედავად იმისა, რომ ეპითელიუმის დისპლაზიასა და HPV ინფექციას ცენტრალური როლი უჭირავს საშვილოსნოს ყელის კარცინოგენეზში, სტრომული მიკროგარემოს ცვლილებები და ნერვული რემოდელირება ჯერ კიდევ ყველაზე ნაკლებად შესწავლილ სფეროდ რჩება. ჩვენი კვლევა შეისწავლის პერიფერიული ნერვული ბოჭკოებისა და ბუნებრივი მკვლელი უჯრედების (NK Cells) განაწილებას საშვილოსნოს ყელის ინტრაეპითელურ ნეოპლაზიისა და ინვაზიური ბრტყელუჯრედოვანი კარცინომის სპექტრში. საშვილოსნოს ყელის ორმოცდახუთი ნიმუში (9 ნორმალური, CIN1, CIN2, CIN3 და SCC) დამატებით შეიღება PGP9.5, S100, CD56 და CD34-ის ანტისხეულების გამოყენებით. ნერვული ბოჭკოების სიმკვრივე, ნერვული ბოჭკოს მაქსიმალური დიამეტრი და დაშორება ბაზალური მემბრანიდან რაოდენობრივად, ხოლო S100 და CD56 ექსპრესია ნახევრად რაოდენობრივად იქნა შეფასებული. დაფიქსირდა PGP9.5-დადებითი ნერვული ბოჭკოების პროგრესული ზრდა CIN1-დან SCC-მდე, რასაც ასევე თან ახლავს ნერვული ბოჭკოების დიამეტრის გაზრდა. S100 ექსპრესია მომატებული იყო განსაკუთრებით HPV-დადებით CIN3 და SCC შემთხვევებში. ნერვული ბოჭკოების პერიეპითელური კლასტერირება საგრძნობლად მომატებული იყო მაღალი ხარისხის დაზიანებებში, რაც მიუთითებს ადრეულ პერინეოპლაზიურ ნერვულ რემოდელირებაზე. ნერვული ბოჭკოების ჰიპერტროფია პროგრესულად მატულობდა დისპლაზიის მატებასთან ერთად. ნაწილი ბოჭკოების არის ჩვეულებრივი ნაწილი კი ნეოანგიოგენეზის შედეგად მიღებული ნეიროგენეზური ბოჭკოები. CIN3 და SCC შემთხვევებში NK (ბუნევრივი მკვლელი უჯრედები) მკვეთრად შემცირებულია, რაც იმით აიხსნება, რომ ამ ეტაპზე დომინირებს ნეონეიროგენეზური ბოჭკოების არსებობა. თავდაპირველად დისპლაზიის დაბალ ხარისხის შემთხვევებში ჰიპერტროფიასთან ერთად მატულობს NK უჯრედების ჰიპერპლაზია თუმცა CIN3 და SCC შემთხვევებში მისი რაოდენობა მინიმალურია. რაც შესაძლოა წარმოადგენდეს ნეირორეგულაციიდან გაქცევის/სიმსივნის იმუნური სისტემისაგან გაქცევის გამოვლინებას. აღნიშნული შედეგები შესაძლოა სამომავლოდ გამოყენებული იქნას იმუნოთერაპიული საშუალებების დახვეწასა და NK-ტარგეტული საშუალებების შემუშავებაში.
Downloads
მიმოხილვაკრიტიკული, გოგიტიძეგიორგი, კეპულაძეშოთა, თევზაძენინო, and ბურკაძეგიორგი, “The Role of the Local Neural microenvironment in the Progression of cervical intraepithelial Neoplasia,” Georgian Scientists, vol. 5, no. 3, pp. 182–188, Sep. 2023, doi: 10.52340/2023.05.03.19.
B. Boilly, S. Faulkner, P. Jobling, and H. Hondermarck, “Nerve Dependence: From Regeneration to Cancer,” Cancer Cell, vol. 31, no. 3, pp. 342–354, Mar. 2017, doi: 10.1016/J.CCELL.2017.02.005.
W. Wang et al., “Nerves in the Tumor Microenvironment: Origin and Effects,” Front Cell Dev Biol, vol. 8, Dec. 2020, doi: 10.3389/FCELL.2020.601738.
S. Faulkner, P. Jobling, B. March, C. C. Jiang, and H. Hondermarck, “Tumor neurobiology and the war of nerves in cancer,” Cancer Discov, vol. 9, no. 6, pp. 702–710, Jun. 2019, doi: 10.1158/2159-8290.CD-18-1398.
P. D. Vermeer, “Exosomal induction of tumor innervation,” Cancer Res, vol. 79, no. 14, pp. 3529–3535, 2019, doi: 10.1158/0008-5472.CAN-18-3995.
J. Bründl, S. Schneider, F. Weber, F. Zeman, W. F. Wieland, and R. Ganzer, “Computerized quantification and planimetry of prostatic capsular nerves in relation to adjacent prostate cancer foci,” Eur Urol, vol. 65, no. 4, pp. 802–808, Apr. 2014, doi: 10.1016/J.EURURO.2013.04.043.
C. T. Lucido et al., “Innervation of cervical carcinoma is mediated by cancer-derived exosomes,” Gynecol Oncol, vol. 154, no. 1, pp. 228–235, Jul. 2019, doi: 10.1016/J.YGYNO.2019.04.651.
L. Gao, H. Bo, Y. Wang, J. Zhang, and M. Zhu, “Neurotrophic factor Artemin promotes invasiveness and neurotrophic function of pancreatic Adenocarcinoma in vivo and in vitro,” Pancreas, vol. 44, no. 1, pp. 134–143, Jan. 2015, doi: 10.1097/MPA.0000000000000223.
S. Gillespie and M. Monje, “The Neural Regulation of Cancer,” Annu Rev Cancer Biol, vol. 4, pp. 371–390, Mar. 2020, doi: 10.1146/ANNUREV-CANCERBIO-030419-033349.
M. Arese, F. Bussolino, M. Pergolizzi, L. Bizzozero, and D. Pascal, “Tumor progression: the neuronal input,” Ann Transl Med, vol. 6, no. 5, pp. 89–89, Mar. 2018, doi: 10.21037/ATM.2018.01.01.
C. Magnon et al., “Autonomic nerve development contributes to prostate cancer progression,” Science (1979), vol. 341, no. 6142, 2013, doi: 10.1126/SCIENCE.1236361.
T. Dzotsenidze, A. Gvenetadze, M. Gachechiladze, G. Burkadze, and S. Kepuladze, “Immunohistochemical phenotype of fallopian tubes in patients with different grades of serous ovarian carcinoma,” Indian Journal of Pathology and Oncology Journal homepage: www.ijpo.co.in Original Research Article, vol. 9, no. 4, pp. 301–305, 2022, doi: 10.18231/j.ijpo.2022.073.
M. Głowienka-Stodolak et al., “Human Papillomavirus Infections and the Role Played by Cervical and Cervico-Vaginal Microbiota—Evidence from Next-Generation Sequencing Studies,” Cancers (Basel), vol. 16, no. 2, p. 399, Jan. 2024, doi: 10.3390/CANCERS16020399.
M. Schiffman and N. Wentzensen, “Human papillomavirus infection and the multistage carcinogenesis of cervical cancer,” Cancer Epidemiol Biomarkers Prev, vol. 22, no. 4, pp. 553–560, Apr. 2013, doi: 10.1158/1055-9965.EPI-12-1406.
საავტორო უფლებები (c) 2025 ქართველი მეცნიერები

ეს ნამუშევარი ლიცენზირებულია Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 საერთაშორისო ლიცენზიით .