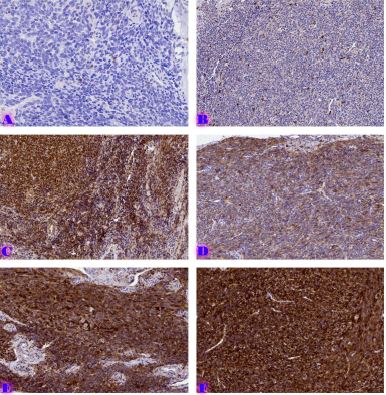
Vascular Remodeling Across the Spectrum of Cervical Intraepithelial Neoplasia and Squamous Cell Carcinoma: A Digital Pathology-Based Morphometric and Immunohistochemical Analysis
Downloads
Angiogenesis is a critical component of tumour progression, yet its role in precancerous lesions of the cervix remains underexplored. Cervical intraepithelial neoplasia (CIN) grades 1 to 3 represent a histological continuum toward invasive squamous cell carcinoma (SCC), primarily driven by persistent high-risk human papillomavirus (HPV) infection. This study investigates vascular remodelling across the CIN spectrum and SCC using morphometric and immunohistochemical (IHC) approaches.
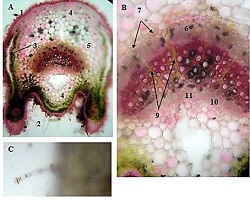
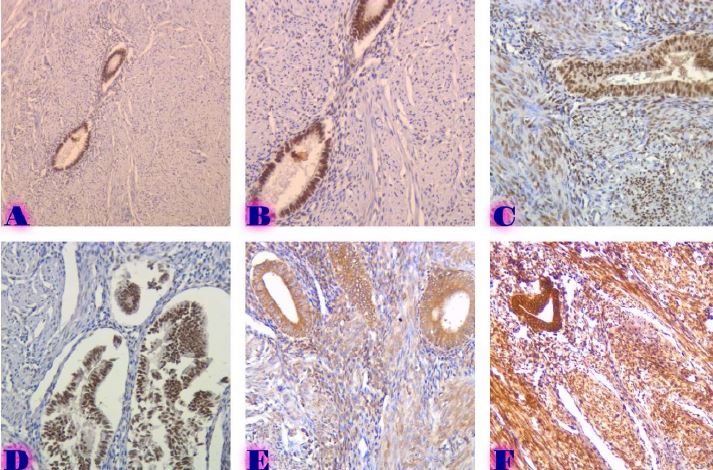
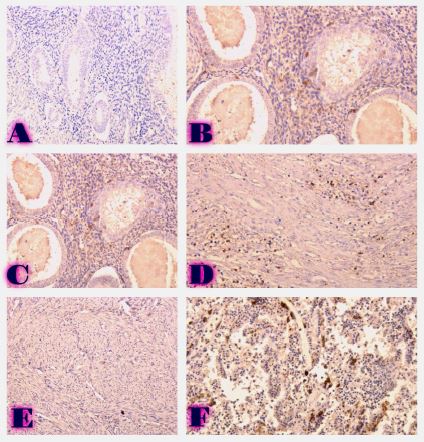
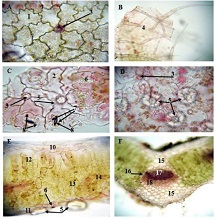
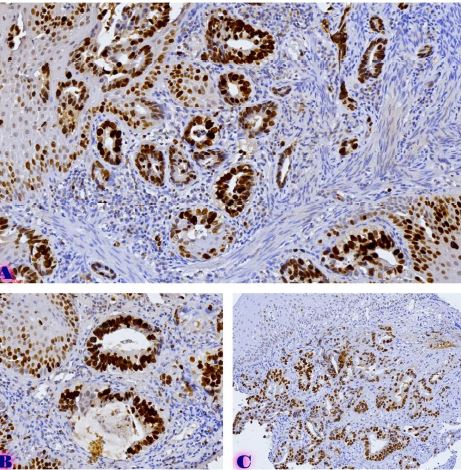
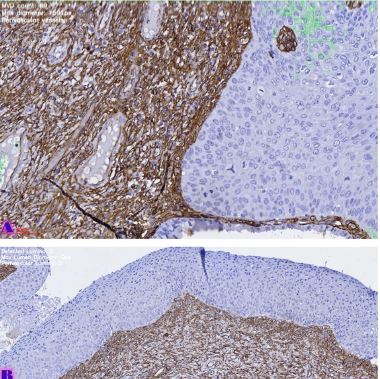
Methods: Archival cervical tissue samples (n=5; normal cervix, CIN1–CIN3, invasive SCC) were retrieved from the Tbilisi State Medical University laboratory. Clinical data included patient age, HPV status, and menstrual status. IHC for CD34 and CD31 was performed. Digital pathology analysis using Motic EasyScan, QuPath, and ImageJ assessed microvessel density (MVD), vessel diameter, vascular orientation, perivascular localisation, inflammation, and fibrosis.
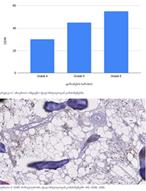
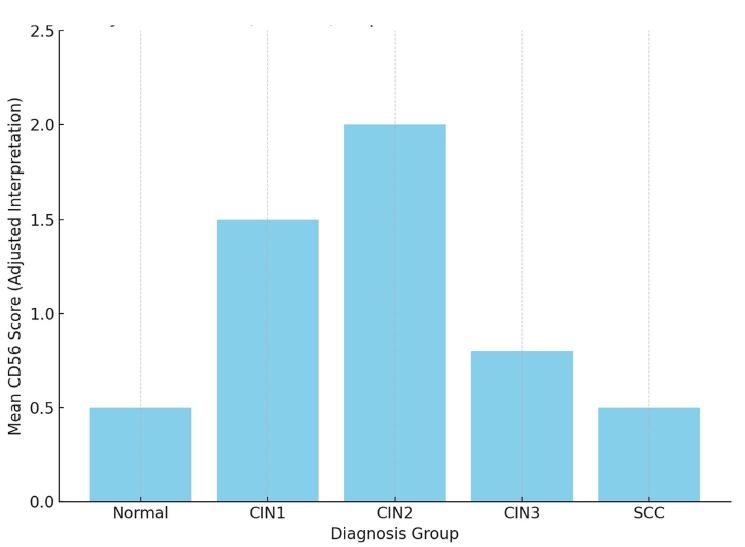
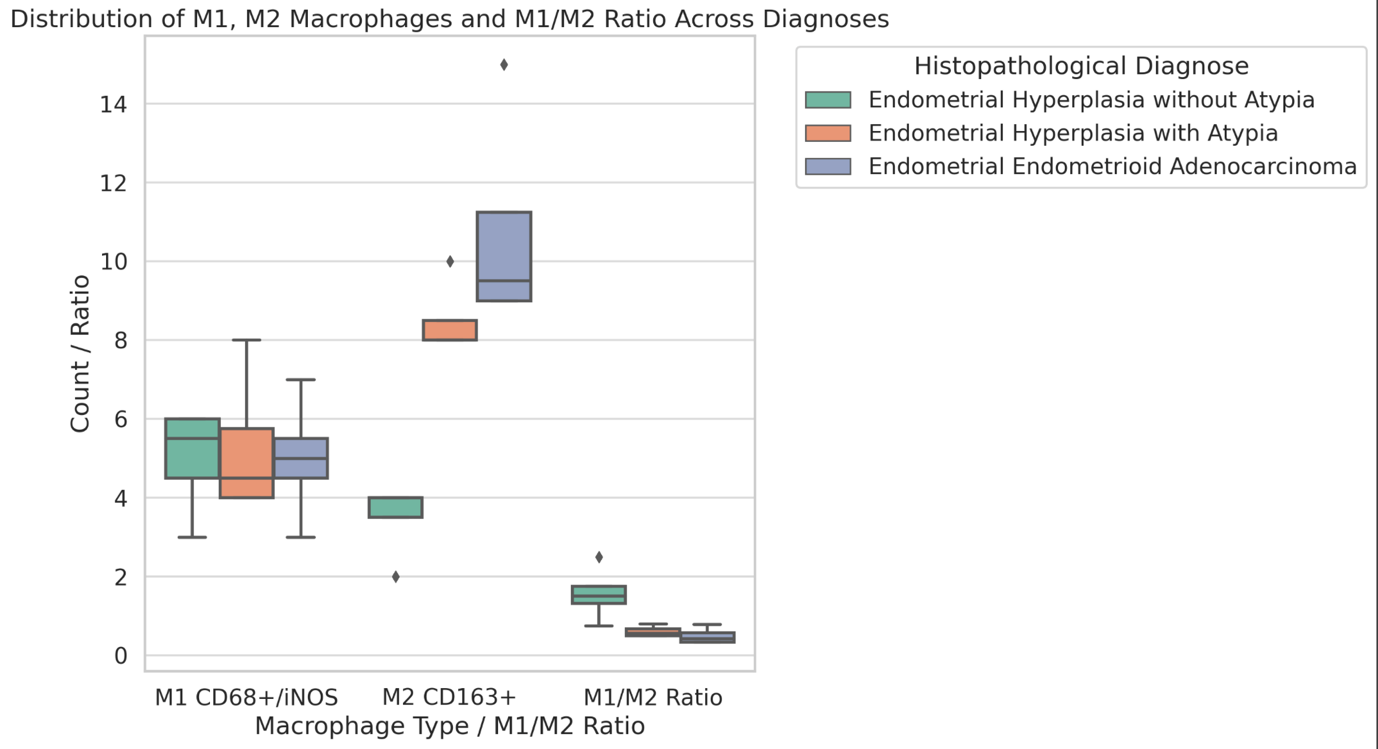
Results: CD34-based MVD increased progressively from the normal cervix (90 vessels/mm²) to invasive SCC (250 vessels/mm²). Vessel diameter expanded from 4 µm in normal tissue to 20 µm in CIN3. Vascular orientation shifted from parallel to chaotic. Perivascular clustering and VEGF expression also intensified with lesion grade. All vascular features showed a strong positive correlation with CIN severity (Spearman ρ > 0.89; p < 0.01). Kruskal-Wallis testing confirmed significant differences across groups (p < 0.01 for MVD, diameter). This study highlights progressive vascular remodelling as a key feature of CIN advancement and transition to invasive carcinoma. Combined morphometric and IHC analysis reveals early and measurable changes in the cervical stromal microvasculature, with implications for early diagnosis, biomarker development, and therapeutic targeting of angiogenesis in cervical neoplasia.
Downloads
T. Svanadze, S. Kepuladze, N. Tevzadze, and G. Burkadze, “ASSESSMENT OF PROLIFERATIVE ACTIVITY OF DIFFERENT TYPES OF SQUAMOUS CELL METAPLASIA OF THE CERVIX USING AgNor TECHNOLOGY,” ქართველი მეცნიერები, vol. 5, no. 2, pp. 275–287, Jun. 2023, doi: 10.52340/gs.2023.05.02.35.
A. Alrajjal, V. Pansare, M. S. R. Choudhury, M. Y. A. Khan, and V. B. Shidham, “Squamous intraepithelial lesions (SIL: LSIL, HSIL, ASCUS, ASC-H, LSIL-H) of Uterine Cervix and Bethesda System,” Cytojournal, vol. 18, p. 16, 2021, doi: 10.25259/CYTOJOURNAL_24_2021.
A. Harsh, R. Tondon, H. K. Harsh, and E. Professor, “Utility of AgNOR Count in Non-Neoplastic and Neoplastic Lesions of the Uterine Cervix,” Original Research Article, vol. 198, no. 1, pp. 198–201, 2018, doi: 10.21276/ijmrp.2018.4.1.039.
B. Boilly, S. Faulkner, P. Jobling, and H. Hondermarck, “Nerve Dependence: From Regeneration to Cancer,” Cancer Cell, vol. 31, no. 3, pp. 342–354, Mar. 2017, doi: 10.1016/J.CCELL.2017.02.005.
S. A. Hong, S. H. Yoo, J. Choi, S. J. Robboy, and K.-R. Kim, “A Review and Update on Papillary Immature Metaplasia of the Uterine Cervix: A Distinct Subset of Low-Grade Squamous Intraepithelial Lesion, Proposing a Possible Cell of Origin.,” Arch Pathol Lab Med, vol. 142, no. 8, pp. 973–981, Aug. 2018, doi: 10.5858/arpa.2017-0267-OA.
S. Faulkner, P. Jobling, B. March, C. C. Jiang, and H. Hondermarck, “Tumor neurobiology and the war of nerves in cancer,” Cancer Discov, vol. 9, no. 6, pp. 702–710, Jun. 2019, doi: 10.1158/2159-8290.CD-18-1398.
მიმოხილვაკრიტიკული, გოგიტიძეგიორგი, კეპულაძეშოთა, თევზაძენინო, and ბურკაძეგიორგი, “The Role of the Local Neural microenvironment in the Progression of cervical intraepithelial Neoplasia,” Georgian Scientists, vol. 5, no. 3, pp. 182–188, Sep. 2023, doi: 10.52340/2023.05.03.19.
H. K. Mehdi, K. Raju, and S. R. Sheela, “Association of P16, Ki-67, and CD44 expression in high-grade squamous intraepithelial neoplasia and squamous cell carcinoma of the cervix,” J Cancer Res Ther, vol. 19, no. Supplement, pp. S260–S267, Apr. 2023, doi: 10.4103/JCRT.JCRT_43_21.
C. Magnon et al., “Autonomic nerve development contributes to prostate cancer progression,” Science (1979), vol. 341, no. 6142, 2013, doi: 10.1126/SCIENCE.1236361.
M. Arese, F. Bussolino, M. Pergolizzi, L. Bizzozero, and D. Pascal, “Tumor progression: the neuronal input,” Ann Transl Med, vol. 6, no. 5, pp. 89–89, Mar. 2018, doi: 10.21037/ATM.2018.01.01.
S. Gillespie and M. Monje, “The Neural Regulation of Cancer,” Annu Rev Cancer Biol, vol. 4, pp. 371–390, Mar. 2020, doi: 10.1146/ANNUREV-CANCERBIO-030419-033349.
L. Gao, H. Bo, Y. Wang, J. Zhang, and M. Zhu, “Neurotrophic factor Artemin promotes invasiveness and neurotrophic function of pancreatic Adenocarcinoma in vivo and in vitro,” Pancreas, vol. 44, no. 1, pp. 134–143, Jan. 2015, doi: 10.1097/MPA.0000000000000223.
C. T. Lucido et al., “Innervation of cervical carcinoma is mediated by cancer-derived exosomes,” Gynecol Oncol, vol. 154, no. 1, pp. 228–235, Jul. 2019, doi: 10.1016/J.YGYNO.2019.04.651.
J. Bründl, S. Schneider, F. Weber, F. Zeman, W. F. Wieland, and R. Ganzer, “Computerized quantification and planimetry of prostatic capsular nerves in relation to adjacent prostate cancer foci,” Eur Urol, vol. 65, no. 4, pp. 802–808, Apr. 2014, doi: 10.1016/J.EURURO.2013.04.043.
Copyright (c) 2025 Georgian Scientists

This work is licensed under a Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.