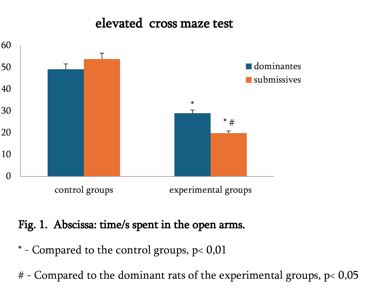
T ლიმფოციტების სუბპოპულაციების ცვლილებები სხვადასხვა ტიპის ენტერიტის დროს

ჩამოტვირთვები
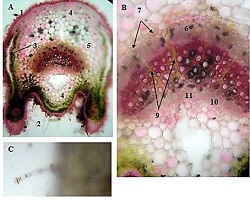
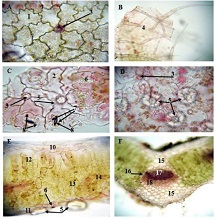
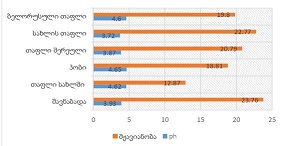
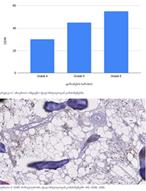
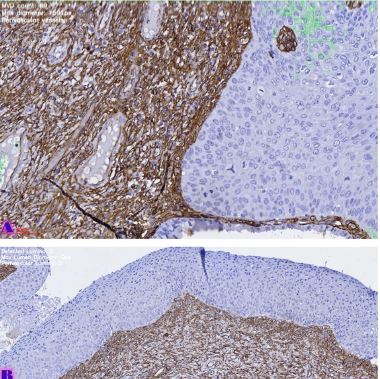
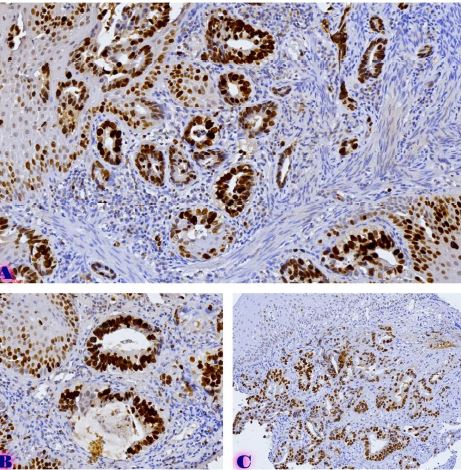
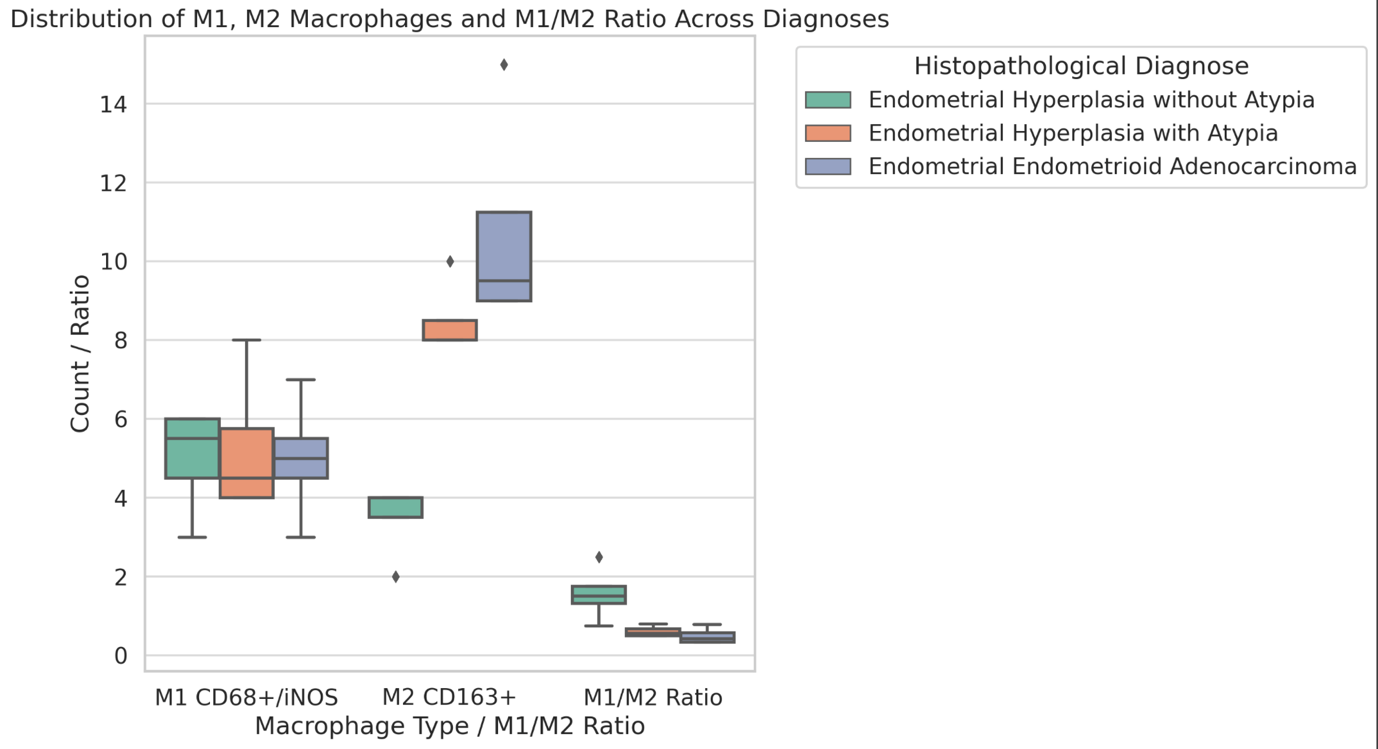
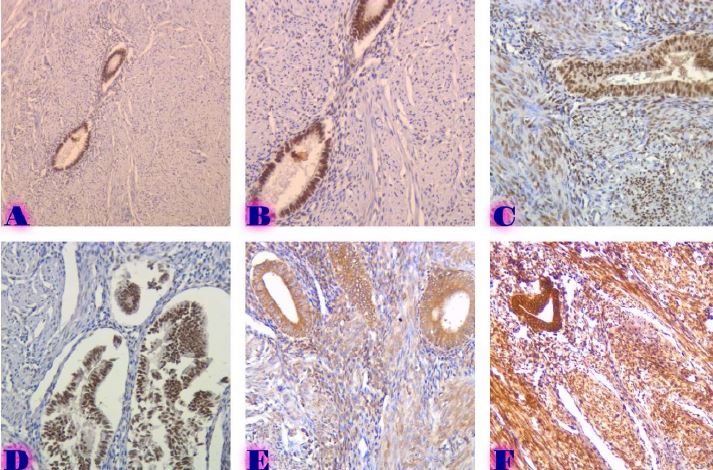
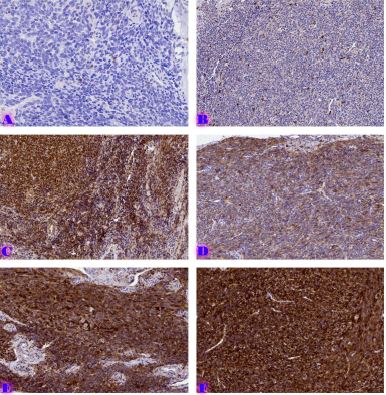
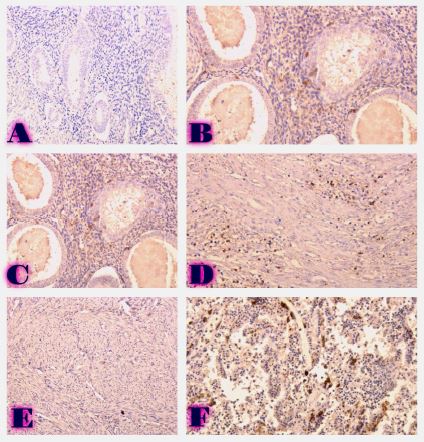
ცელიაკია არის წვრილი ნაწლავის იმუნურად გაშუალებული ანთებითი მდგომარეობა, რომელიც განპირობებულია გლუტენის საწინააღმდეგო ანტისხეულებით გენეტიკურად წინასწარგნაწყობილ პირებში. დიაგნოსტიკისთვის რეკომენდებულია ნაწლავის ბიოფსია, რომელიც ავლენს ინტრაეპითელური ლიმფოციტების (intraepithelial lymphocytes (IELs)) გაზრდილ რაოდენობას, კრიპტების ჰიპერპლაზიასა და ხაოების ატროფიას (Marsh II, Marsh III). ხშირ შემთხვევაში მნიშვნელოვანია ცელიიაკის დიფერენცირება ქრონიკული ლიმფოციტური დუოდენიტისგან, რომლის დროსაც, შესაძლოა, გამოვლინდება ხაოების მინამალური ატროფია, კრიპტების ზომიერი ჰიპერპლაზია, საკუთარი ფირფიტის ლიმფოციტებით, პლაზმური უჯრედებითა და ეოზინოფილებით ინფილტრაცია. ძირითადი განსხვავება მოიცავს ინტრაეპითელური ლიმფოციტების რაოდენობას. ჩვენი კვლევის შედეგებმა გვიჩვენა, რომ CD103 წარმოადგენს ყველაზე სენსიტიურ მარკერს ქრონიკული ლიმფოციტური დუოდენიტისა და ცელიაკიის დიფერენცირებისთვის. CD103 წარმოადგენს ყველაზე სენსიტიურ მარკერს სხვადასხვა ხარისხის ცელიაკიის შეფასებისთვის.
Downloads
S. Rahmani et al., “Gluten-Dependent Activation of CD4+ T Cells by MHC Class II–Expressing Epithelium,” Gastroenterology, vol. 167, no. 6, pp. 1113–1128, Nov. 2024, doi: 10.1053/j.gastro.2024.07.008.
U. Volta et al., “Minimal Lesions of the Small Intestinal Mucosa: More than Morphology,” Dig Dis Sci, vol. 65, no. 10, pp. 2761–2768, Oct. 2020, doi: 10.1007/s10620-020-06571-1.
L. F. Risnes et al., “Circulating CD103+ γδ and CD8+ T cells are clonally shared with tissue-resident intraepithelial lymphocytes in celiac disease.,” Mucosal Immunol, vol. 14, no. 4, pp. 842–851, Jul. 2021, doi: 10.1038/s41385-021-00385-8.
K. Artykiewicz et al., “Celiac disease - a review on recent advances in characteristics, diagnostic and treatments,” Journal of Education, Health and Sport, vol. 13, no. 1, pp. 11–17, Nov. 2022, doi: 10.12775/JEHS.2023.13.01.001.
R. Del Sordo et al., “Histological Features of Celiac-Disease-like Conditions Related to Immune Checkpoint Inhibitors Therapy: A Signal to Keep in Mind for Pathologists,” Diagnostics, vol. 12, no. 2, p. 395, Feb. 2022, doi: 10.3390/diagnostics12020395.
T. Nikolaishvili, T. Parulava, I. Mamuchishvili, N. Kantaria, and G. Burkadze, “Histological and immunohistochemical profile of lymphocytic duodenitis and features of local immune reactions,” GEORGIAN SCIENTISTS, Dec. 2023, doi: 10.52340/gs.2023.05.04.23.
Y. Sahin, “Celiac disease in children: A review of the literature,” World J Clin Pediatr, vol. 10, no. 4, pp. 53–71, Jul. 2021, doi: 10.5409/wjcp.v10.i4.53.
M. Tinguria, “Pathology of celiac disease: An insight about etiopathogenesis, pathophysiology and histologic diagnosis,” Med Res Arch, vol. 12, no. 9, 2024, doi: 10.18103/mra.v12i9.5696.
V. Vincenzo, S. Gloria, M. Melissa, C. Alessandro, and D. S. Rachele, “Histopathological Assessment of Celiac Disease,” in Advances in Celiac Disease, Cham: Springer International Publishing, 2022, pp. 79–97. doi: 10.1007/978-3-030-82401-3_7.
R. Sali et al., “CeliacNet: Celiac Disease Severity Diagnosis on Duodenal Histopathological Images Using Deep Residual Networks,” Oct. 2019.
V. Villanacci et al., “Celiac disease: histology-differential diagnosis-complications. A practical approach,” Pathologica, vol. 112, no. 3, pp. 186–196, Sep. 2020, doi: 10.32074/1591-951X-157.
T. Nikolaishvili, T. Farulava, I. Mamuchishvili, N. Kantaria, and G. Burkadze, “Dynamics of immunocompetent cell distribution in duodenitis and celiac disease,” GEORGIAN SCIENTISTS, Jul. 2024, doi: 10.52340/gs.2024.06.03.05.
საავტორო უფლებები (c) 2025 ქართველი მეცნიერები

ეს ნამუშევარი ლიცენზირებულია Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 საერთაშორისო ლიცენზიით .