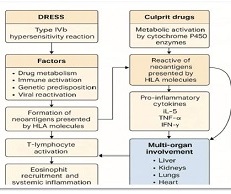
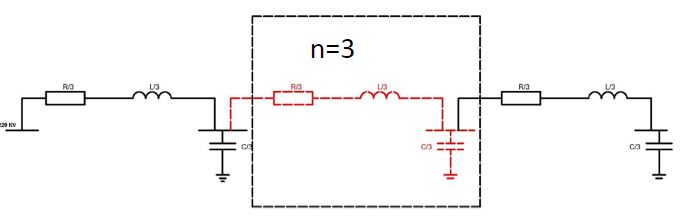
M1 და M2 მაკროფაგების როლი ენდომეტრიუმის ჰიპერპლაზიის ენდომეტროიდულ ადენოკარცინომამდე პროგრესირებაში
ჩამოტვირთვები
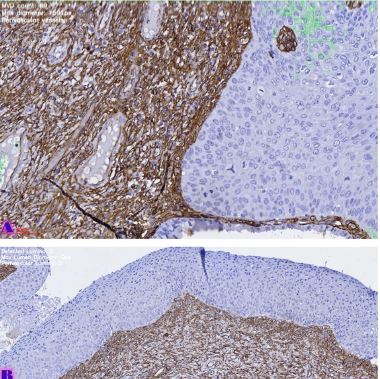
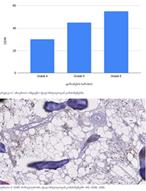
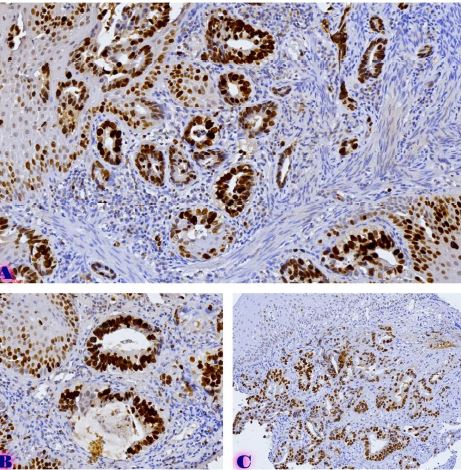
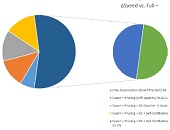
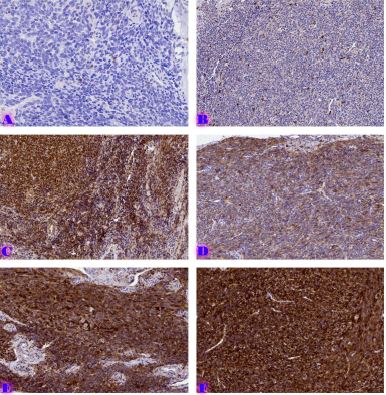
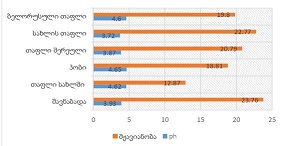
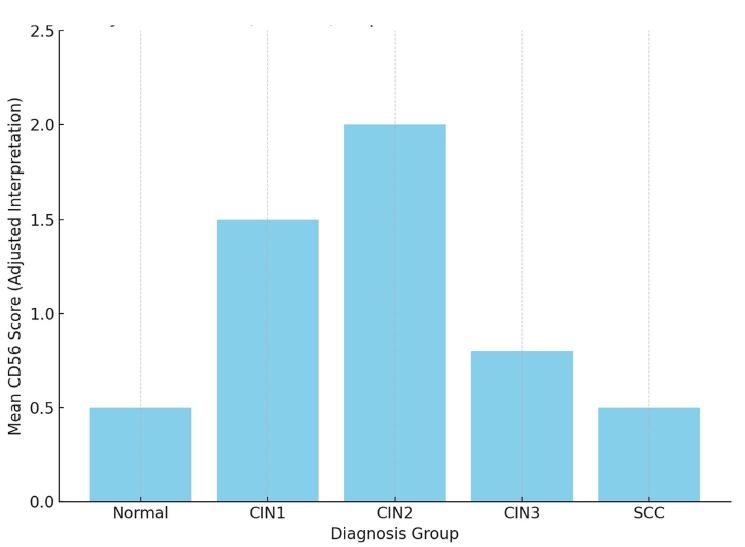
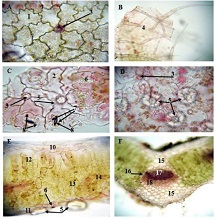
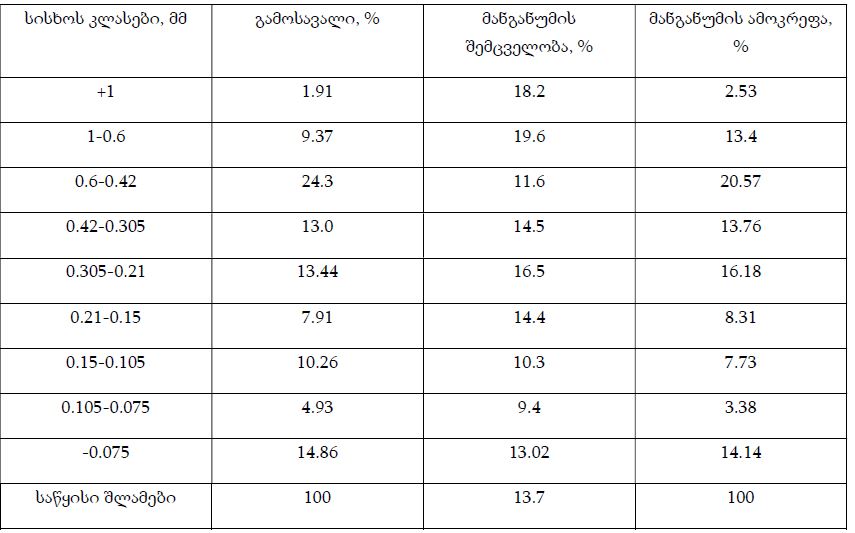
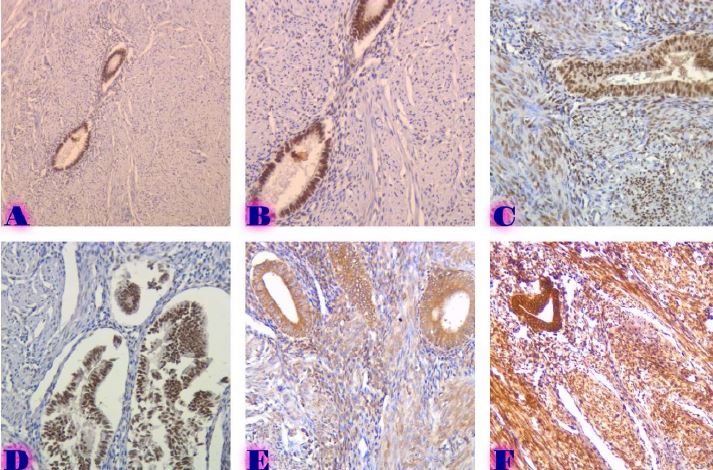
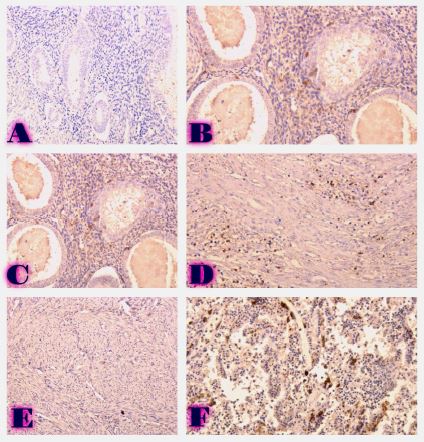
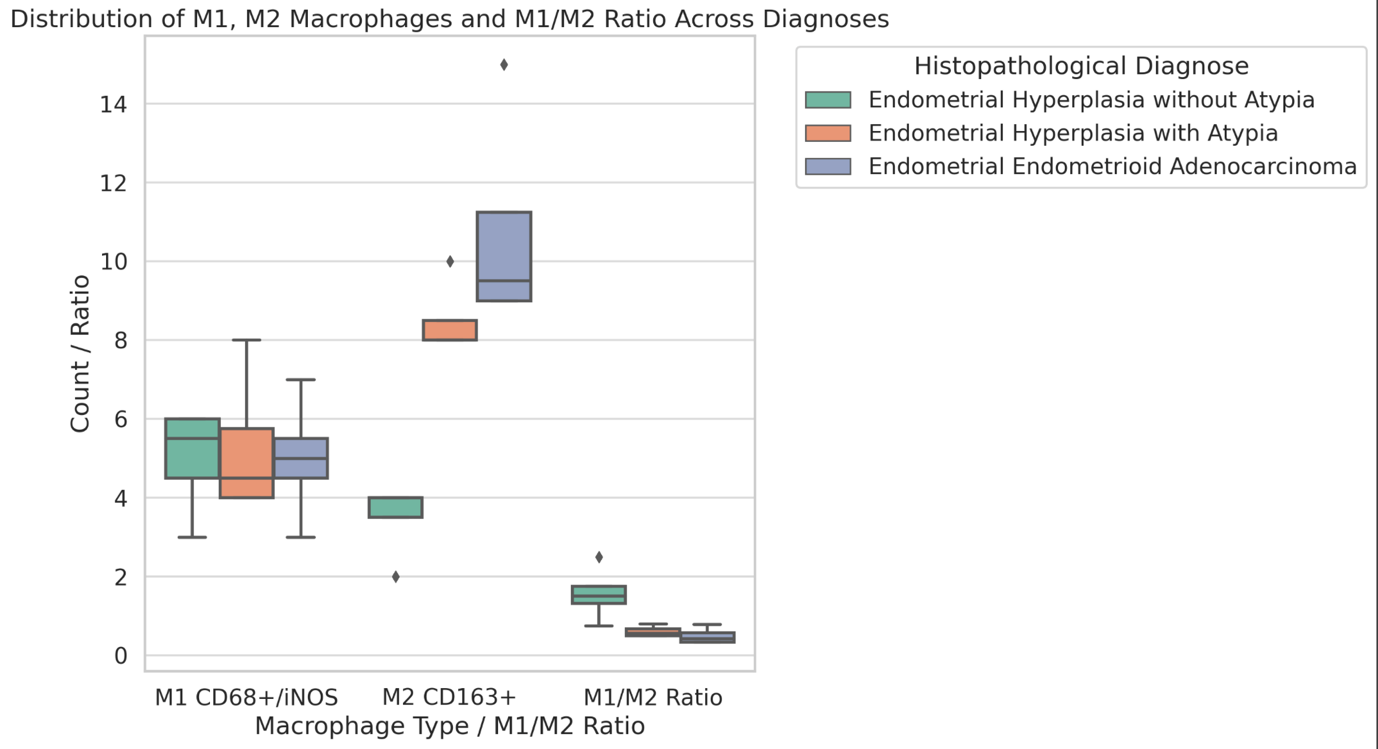
ენდომეტრიუმის კეთილთვისებიან ჰიპერპლაზიიდან ავთვისებიან ადენოკარცინომამდე პროგრესირება მოიცავს იმუნურ მიკროგარემოში სხვადასხვა სახის კომპლექსურ ურთიერთქმედებას. ჩვენი კვლევა მიზნად ისახავდა იმუნოჰისტოქიმიური ტექნოლოგიის გამოყენებით სხვადასხვა მარკერის ექსპრესიის შეფასებას, როგორიცაა მაგალითად M1/M2 მაკროფაგები. ასევე M1/M2 თანაფარდობას, ჰორმონული პროფილის ექსპრესიასა და სიმსივნის მაინფილტრირებელ ლიმფოციტებს (TILs) შორის შესაძლო კავშირის გამოსავლენას. კვლევის დიზაინს წარმოადგენდა რეტროსპექტული კოჰორტული კვლევა და მოიცავდა 120 შემთხვევას, რომლებიც გადანაწილებულია სამ ნოზოლოგიურ ერთეულში: ენდომეტრიუმის ჰიპერპლაზია ატიპიის გარეშე, ჰიპერპლაზია ატიპიით და ენდომეტრიუმის ენდომეტროიდული ადენოკარცინომა. M1/M2 თანაფარდობა და ER/PR ექსპრესია შეფასდა იმუნოჰისტოქიმიური კვლევის ტექნოლოგიის გამოყენებით. ჩვენმა კვლევამ აჩვენა, რომ M1/M2 თანაფარდობა თანდათან მცირდება ენდომეტრიუმის მარტივი ტიპის ჰიპერპლაზიიდან (საშუალოდ: 2.0) ადენოკარცინომამდე (საშუალოდ: 0.5, p <0.01) პროგრესირებისას, რაც მიუთითებს გადასვლას ანთების საწინააღმდეგოდან (M1 მაკროფაგები) იმუნოსუპრესიულ (M2 მაკროფაგები) მიკროგარემოზე. ჩვენი კვლევის შედეგები აჩვენებს იმუნური და ჰორმონური ფაქტორების კრიტიკულ როლს ენდომეტრიუმის სხვადასხვა ტიპის დაზიანებების პროგრესირებაში. M1/M2 კოეფიციენტის დაქვეითება, TIL-ის პროცენტული მაჩვენებლის ზრდა და ER/PR ექსპრესიის შემცირება დაკავშირებულია ენდომეტრიუმის სიმსივნისწინარე მდგომარეობების ავთვისებიან პროგრესიასთან და დაავადების სიმძიმესთან. ჩვენი კვლევის შედეგები კიდევ ერთხელ ხაზს უსვამს იმუნური მიკროგარემოსა და ჰორმონური გზების მიმართ პერსონალიზებული თერაპიული სტრატეგიების პოტენციალს. საჭიროა ამ მიმართულებით დამატებითი კვლევები ბიომარკერების პერსპექტიული გამოყენებისათვის.
Downloads
J. Tu et al., “Growth arrest-specific transcript 5 represses endometrial cancer development by promoting antitumor function of tumor-associated macrophages,” Cancer Sci, vol. 113, no. 8, pp. 2496–2512, Aug. 2022, doi: 10.1111/cas.15390.
S. Mei et al., “PRMT5 promotes progression of endometrioid adenocarcinoma via ERα and cell cycle signaling pathways,” Journal of Pathology: Clinical Research, vol. 7, no. 2, pp. 154–164, Mar. 2021, doi: 10.1002/cjp2.194.
M. Bied, W. W. Ho, F. Ginhoux, and C. Blériot, “Roles of macrophages in tumor development: a spatiotemporal perspective,” Cell Mol Immunol, vol. 20, no. 9, pp. 983–992, Sep. 2023, doi: 10.1038/s41423-023-01061-6.
H. Tong et al., “Tumor-associated macrophage-derived CXCL8 could induce ERα suppression via HOXB13 in endometrial cancer,” Cancer Lett, vol. 376, no. 1, pp. 127–136, Jun. 2016, doi: 10.1016/J.CANLET.2016.03.036.
B. Allard, M. S. Longhi, S. C. Robson, and J. Stagg, “The ectonucleotidases CD39 and CD73: Novel checkpoint inhibitor targets,” Immunol Rev, vol. 276, no. 1, pp. 121–144, Mar. 2017, doi: 10.1111/IMR.12528.
A. S. Uduwela, M. A. K. Perera, L. Aiqing, and I. S. Fraser, “Endometrial-myometrial interface: Relationship to adenomyosis and changes in pregnancy,” Obstet Gynecol Surv, vol. 55, no. 6, pp. 390–400, Jun. 2000, doi: 10.1097/00006254-200006000-00025.
C. Ozturk, G. Askan, S. Duman Ozturk, O. Okcu, B. Sen, and R. Bedir, “High Tumor Infiltrating Lymphocytes Are Associated with Overall Survival and Good Prognostic Parameters in Endometrial Endometrioid Carcinoma Patients,” Turkish Journal of Pathology, vol. 39, no. 1, p. 75, 2023, doi: 10.5146/TJPATH.2022.01596.
A. Camboni and E. Marbaix, “Ectopic endometrium: The pathologist’s perspective,” Int J Mol Sci, vol. 22, no. 20, Oct. 2021, doi: 10.3390/IJMS222010974.
X. F. Jiang et al., “Tumor-associated macrophages correlate with progesterone receptor loss in endometrial endometrioid adenocarcinoma,” Journal of Obstetrics and Gynaecology Research, vol. 39, no. 4, pp. 855–863, Apr. 2013, doi: 10.1111/j.1447-0756.2012.02036.x.
X. F. Jiang et al., “Tumor-associated macrophages correlate with progesterone receptor loss in endometrial endometrioid adenocarcinoma,” Journal of Obstetrics and Gynaecology Research, vol. 39, no. 4, pp. 855–863, Apr. 2013, doi: 10.1111/j.1447-0756.2012.02036.x.
A. Vanderstraeten, S. Tuyaerts, and F. Amant, “The immune system in the normal endometrium and implications for endometrial cancer development,” J Reprod Immunol, vol. 109, pp. 7–16, Jun. 2015, doi: 10.1016/J.JRI.2014.12.006.
Y. Pan, Y. Yu, X. Wang, and T. Zhang, “Tumor-Associated Macrophages in Tumor Immunity,” Front Immunol, vol. 11, p. 583084, Dec. 2020, doi: 10.3389/FIMMU.2020.583084/BIBTEX.
X. Song, R. Na, N. Peng, W. Cao, and Y. Ke, “Exploring the role of macrophages in the progression from atypical hyperplasia to endometrial carcinoma through single-cell transcriptomics and bulk transcriptomics analysis,” Front Endocrinol (Lausanne), vol. 14, 2023, doi: 10.3389/FENDO.2023.1198944.
A. Mantovani, F. Marchesi, A. Malesci, L. Laghi, and P. Allavena, “Tumour-associated macrophages as treatment targets in oncology,” Nat Rev Clin Oncol, vol. 14, no. 7, pp. 399–416, Jul. 2017, doi: 10.1038/NRCLINONC.2016.217.
Á. López-Janeiro et al., “The association between the tumor immune microenvironments and clinical outcome in low-grade, early-stage endometrial cancer patients,” J Pathol, vol. 258, no. 4, pp. 426–436, Dec. 2022, doi: 10.1002/PATH.6012.
საავტორო უფლებები (c) 2025 ქართველი მეცნიერები

ეს ნამუშევარი ლიცენზირებულია Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 საერთაშორისო ლიცენზიით .