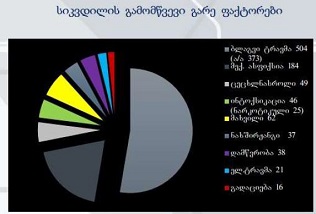
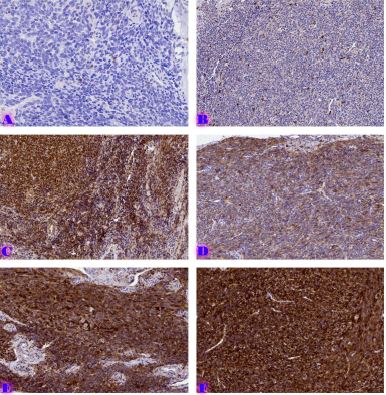
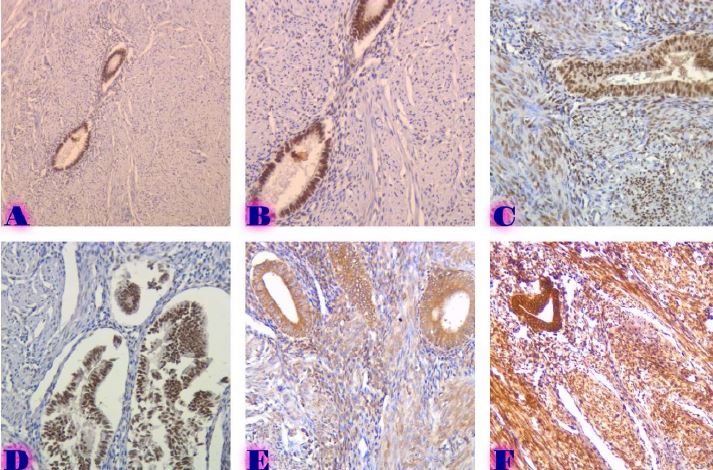
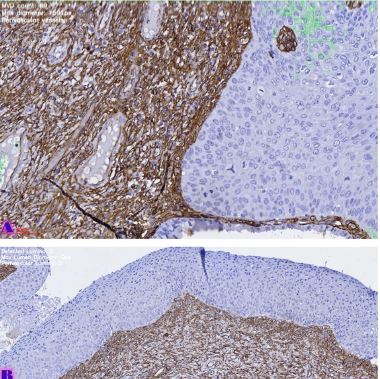
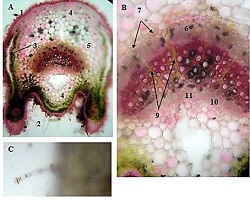
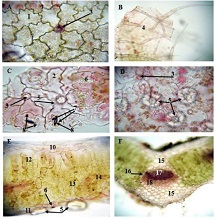
ძუძუს ინვაზიური სადინროვანი კარცინომის შედარებითი ფენოტიპური მახასიათებლები ძირითად კერას, სიმსივნურ უჯრედულ მიკროკლასტერებსა და მეტასტაზურ ლიმფურ კვანძებში Luminal A და Luminal B მოლეკულური ქვეტიპებში
ჩამოტვირთვები
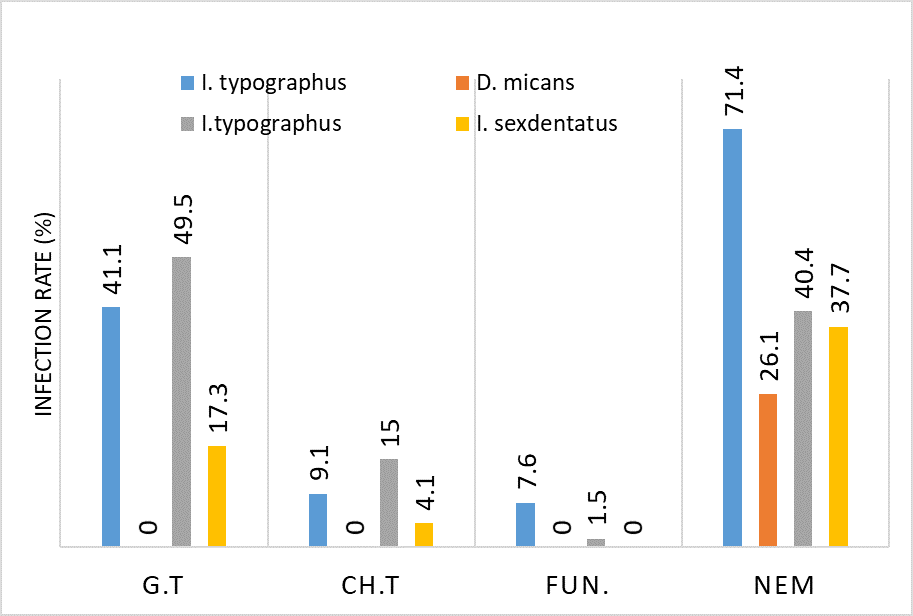
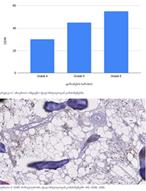
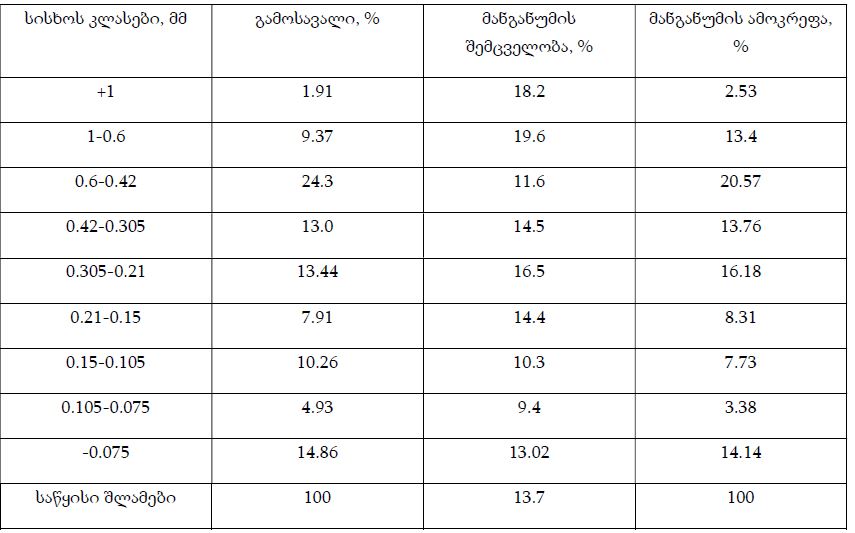
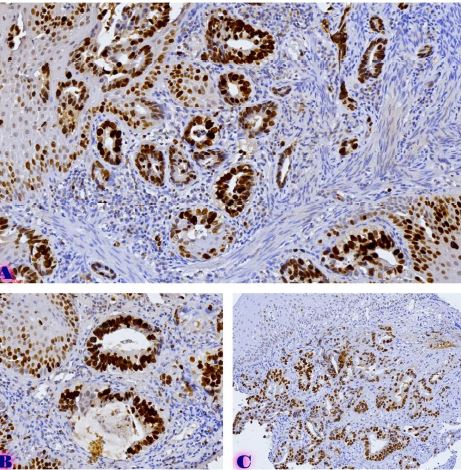
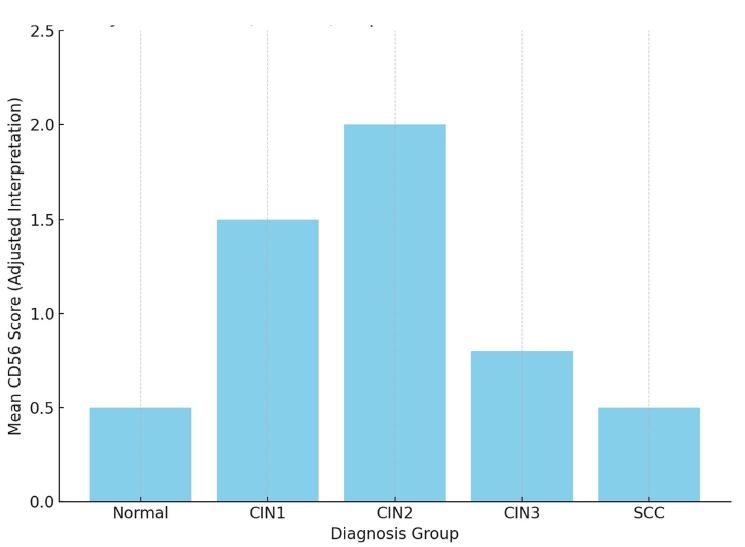
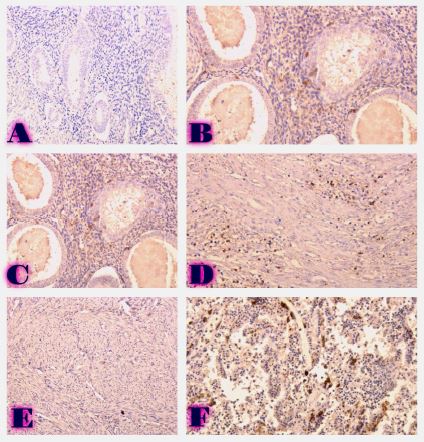
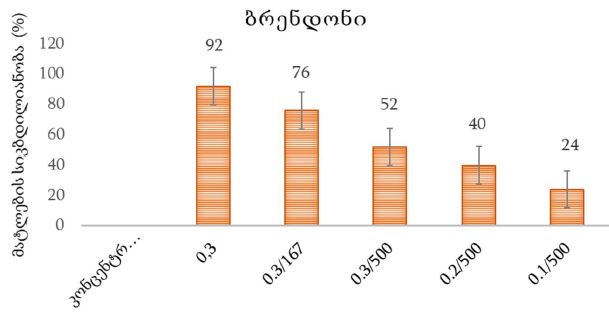
კვლევა მოიცავდა ფორმალინში დაფიქსირებულსა და პარაფინში ჩაყალიბებულ(FFPE) ქსოვილებს საერთო ჯამში ძუძუს ინვაზიური სადინროვანი კარცინომის (NST) 55 შემთხვევას. კვლევის განხორციელებისთვის შემუშავდა შემდეგი ალგორითმი იმუნოჰისტოქიმიური კლევისა და შესაბამისი ანტისხეულების გამოყენებით: ვიმენტინი; ბეტა-კატენინი; E -კადჰერინი; ესტროგენი; პროგესტერონი და Her2, Ki67; სიმსივნის ,,ბადინგი’’ შეფასებული იქნა H&E შეღებილ ანათლებში კომპიუტერული პროგრამის Qupath-ის გამოყენებით (ვერსია 0.3.2). ესტროგენის ექსპრესია განსხვავებულია ძირითად კერასა და სიმსივნურ უჯრედულ მიკროკლასტერებში და მისი ექსპრესია მკვეთრად შემცირებულია ძუძუს Luminal B მოლეკულურ ქვეტიპში. ვიმენტინისა და ბეტა კატენინის ექსპრესია მსგავსი ცვლილებებით ხასიათდება მათი რაოდენობა მკვეთრად მაღალია სიმსივნურ მიკროკლასტერებში ძირითად კერასა და მეტასტაზურ ლიმფურ კვანძებთან შედარებით, რაც ჩვენი აზრით შესაძლებელია წარმოადგენდეს ეპითელურ-მეზენქიმური ტრანსფორმაციის გამოვლინებას. პროლიფერაციული აქტივობის ცვლილებების დინამიკა გვიჩვენებს, რომ პროლიფერაციული აქტივობა ყველაზე ნაკლებია სიმსივნურ უჯრედულ მიკროკლასტერებში, რაც შეიძლება განხილულ იქნას ეპითელურ-მეზენქიმური ტრანსფორმაციის არაპირდაპირ მაჩვენებლად.
Downloads
R. L. Siegel, K. D. Miller, and A. Jemal, “Cancer statistics, 2019,” CA: A Cancer Journal for Clinicians, vol. 69, no. 1, pp. 7–34, Jan. 2019, doi: 10.3322/CAAC.21551.
O. Okcu, Ç. Öztürk, B. Şen, M. Arpa, and R. Bedir, “Tumor Budding is a reliable predictor for death and metastasis in invasive ductal breast cancer and correlates with other prognostic clinicopathological parameters,” Annals of Diagnostic Pathology, vol. 54, Oct. 2021, doi: 10.1016/j.anndiagpath.2021.151792.
F. J. A. Gujam, D. C. McMillan, Z. M. A. Mohammed, J. Edwards, and J. J. Going, “The relationship between tumour budding, the tumour microenvironment and survival in patients with invasive ductal breast cancer,” British Journal of Cancer, vol. 113, no. 7, pp. 1066–1074, Sep. 2015, doi: 10.1038/BJC.2015.287.
B. Salhia et al., “High tumor budding stratifies breast cancer with metastatic properties,” Breast Cancer Research and Treatment, vol. 150, no. 2, pp. 363–371, Apr. 2015, doi: 10.1007/s10549-015-3333-3.
R. Agarwal, N. Khurana, T. Singh, and P. Agarwal, “Tumor budding in infiltrating breast carcinoma: Correlation with known clinicopathological parameters and hormone receptor status,” Indian Journal of Pathology and Microbiology, vol. 62, no. 2, p. 222, Apr. 2019, doi: 10.4103/IJPM.IJPM_120_18.
F. Liang, W. Cao, Y. Wang, L. Li, G. Zhang, and Z. Wang, “The prognostic value of tumor budding in invasive breast cancer,” Pathology Research and Practice, vol. 209, no. 5, pp. 269–275, May 2013, doi: 10.1016/j.prp.2013.01.009.
F. Liang, W. Cao, Y. Wang, L. Li, G. Zhang, and Z. Wang, “The prognostic value of tumor budding in invasive breast cancer,” Pathology Research and Practice, vol. 209, no. 5, pp. 269–275, May 2013, doi: 10.1016/j.prp.2013.01.009.
B. Salhia et al., “High tumor budding stratifies breast cancer with metastatic properties,” Breast Cancer Research and Treatment, vol. 150, no. 2, pp. 363–371, Apr. 2015, doi: 10.1007/S10549-015-3333-3.
B. N. Kumarguru, A. S. Ramaswamy, S. Shaik, A. Karri, V. S. Srinivas, and B. M. Prashant, “Tumor budding in invasive breast cancer - An indispensable budding touchstone,” Indian J Pathol Microbiol, vol. 63, no. Supplement, pp. S117–S122, Feb. 2020, doi: 10.4103/IJPM.IJPM_731_18.
J. van Staalduinen, D. Baker, P. ten Dijke, and H. van Dam, “Epithelial–mesenchymal-transition-inducing transcription factors: new targets for tackling chemoresistance in cancer?,” Oncogene, vol. 37, no. 48, pp. 6195–6211, Nov. 2018, doi: 10.1038/S41388-018-0378-X.
Y. Wu, M. Sarkissyan, and J. v. Vadgama, “Epithelial-mesenchymal transition and breast cancer,” Journal of Clinical Medicine, vol. 5, no. 2, pp. 1–18, Jan. 2016, doi: 10.3390/JCM5020013.
A. Dongre et al., “Epithelial-to-mesenchymal transition contributes to immunosuppression in breast carcinomas,” Cancer Research, vol. 77, no. 15, pp. 3982–3989, Aug. 2017, doi: 10.1158/0008-5472.CAN-16-3292.
M. Matadamas-Guzman, C. Zazueta, E. Rojas, and O. Resendis-Antonio, “Analysis of Epithelial-Mesenchymal Transition Metabolism Identifies Possible Cancer Biomarkers Useful in Diverse Genetic Backgrounds,” Frontiers in Oncology, vol. 10, Jul. 2020, doi: 10.3389/FONC.2020.01309/FULL.
S. Y. Cheung et al., “Role of epithelial–mesenchymal transition markers in triple-negative breast cancer,” Breast Cancer Research and Treatment, vol. 152, no. 3, pp. 489–498, Aug. 2015, doi: 10.1007/S10549-015-3485-1.
V. Mittal, “Epithelial Mesenchymal Transition in Tumor Metastasis,” Annual Review of Pathology: Mechanisms of Disease, vol. 13, pp. 395–412, Jan. 2018, doi: 10.1146/ANNUREV-PATHOL-020117-043854.
I. Zlobec and A. Lugli, “Epithelial mesenchymal transition and tumor budding in aggressive colorectal cancer: tumor budding as oncotarget.,” Oncotarget, vol. 1, no. 7, pp. 651–661, 2010, doi: 10.18632/ONCOTARGET.199.
I. Pastushenko and C. Blanpain, “EMT Transition States during Tumor Progression and Metastasis,” Trends in Cell Biology, vol. 29, no. 3, pp. 212–226, Mar. 2019, doi: 10.1016/J.TCB.2018.12.001.
N. Harbeck, C. Thomssen, and M. Gnant, “St. Gallen 2013: Brief Preliminary Summary of the Consensus Discussion,” 2013, doi: 10.1159/000351193.
P. Bankhead et al., “QuPath: Open source software for digital pathology image analysis,” Scientific Reports, vol. 7, no. 1, Dec. 2017, doi: 10.1038/S41598-017-17204-5.
A. Lugli et al., “Recommendations for reporting tumor budding in colorectal cancer based on the International Tumor Budding Consensus Conference (ITBCC) 2016,” Modern Pathology 2017 30:9, vol. 30, no. 9, pp. 1299–1311, May 2017, doi: 10.1038/modpathol.2017.46.
K. A. Bhuvaneshwari, “Expression of vimentin in breast carcinoma and its correlation with histopathological parameters,” Indian Journal of Pathology and Oncology Journal homepage: www.ijpo.co.in Original Research Article, vol. 8, no. 2, pp. 207–212, 2021, doi: 10.18231/j.ijpo.2021.041.

ეს ნამუშევარი ლიცენზირებულია Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 საერთაშორისო ლიცენზიით .