მარცხენა პარკუჭის ჰიპერტროფია და კარდიომეგალია 10-11 კვირის ცურვით დატვირთულ თეთრ ექსპერიმენტულ ვირთაგვებში
ჩამოტვირთვები
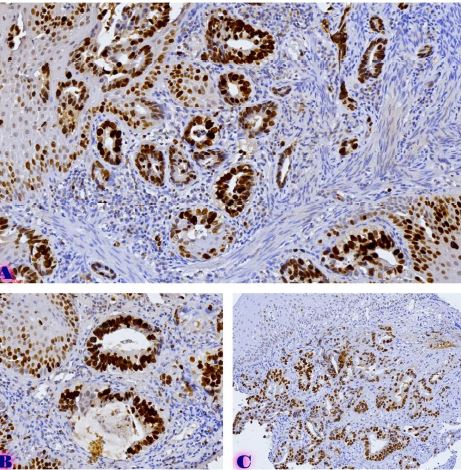
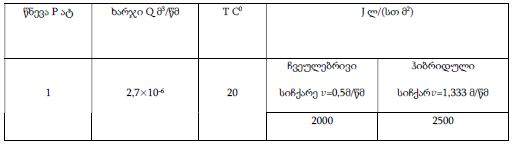
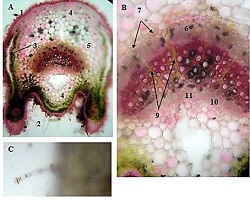
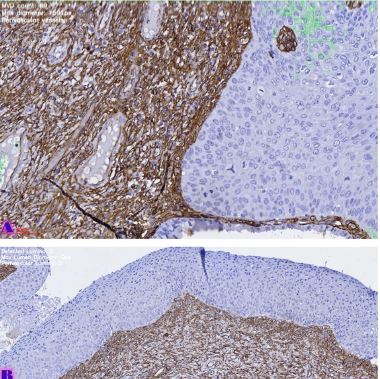
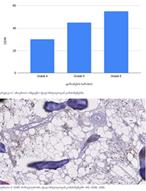
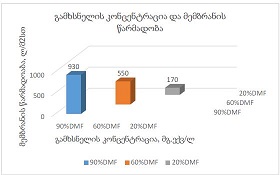
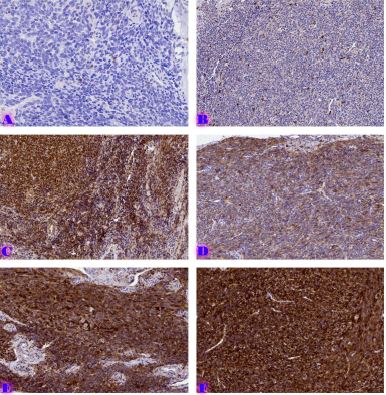
კვლევის მიზანს წარმოადგენდა 10-11 კვირის ვირთაგვებში 6 კვირიანი დოზირებული ცურვით დატვირთვის შემდეგ მარცხენა პარკუჭის ჰიპერტროფიის ხარისხის შეფასება. ზოგადად, ვირთაგვას ცურვით დატვირთვა მიჩნეულია მარცხენა პარკუჭის ჰიპერტროფიის და საბოლოო დიასტოლური მოცულობის ზრდის საუკეთესო ფიზიოლოგიურ ტრიგერად. ჩვენ საკუთარი კვლევის ფარგლებში უზრუნველვყავით მამრობითი სქესის 10-11 კვირის ვირთაგვების დოზირებული ცურვითი დატვირთვა 6 კვირის მანძილზე და შემდეგ შევისწავლეთ გულის მაკრო და მიკროსტრუქტურული პარამეტრები, რათა შეგვეფასებინა ჰიპერტროფიის ხარისხი. ვირთაგვები დავყავით 3 ჯგუფად: 1) საკონტროლო ჯგუფი, რომელიც არ იღებდა დატვირთვას (n=7); 2) პირველი საკვლევი ჯგუფი, რომელსაც უტარდებოდა ყოველდღიური, 40წთ-იანი დატვირთვა ცურვით 6 კვირის მანძილზე, კუდზე მიმაგრებული ტვირთის მასა შეადგენდა ვირთაგვას წონის 2%-ს (n=7). 3) მეორე საკვლევი ჯგუფი, რომელსაც უტარდებოდა ყოველდღიური, 60წთ-იანი დატვირთვა ცურვით 6 კვირის მანძილზე, კუდზე მიმაგრებული ტვირთის მასა შეადგენდა ვირთაგვას წონის 4%-ს (n=7). ჰიპერტროფია ნანახი იქნა მხოლოდ საკვლევი ჯგუფის ვირთაგვებში (დატვირთვა 40 წთ-ის მანძილზე სხეულის მასის 2% ტვირთით ან დატვირთვა 60 წთ-ის მანძილზე სხეულის მასის 4% ტვირთით). გულის წონის შეფარდება სხეულის წონასთან პროპორციულ დამოკიდებულებაშია დატვირთვის ინტენსივობისა და ხანგრძლივობის ზრდასთან. გულის მასის ზრდა ძირითადად ხდებოდა მარცხენა პარკუჭის მასის ზრდის ხარჯზე. ჰისტოლოგიურად 60 წუთიანმა დატვირთვამ გამოიწვია ჰიპერტროფია 7-დან 7 ვირთაგვაში. ხოლო 40 წუთიანი დატვირთვა საკმარისი აღმოჩნდა ჯგუფში ჩარიცხული 7 ვირთაგვიდან 4 ვირთაგვას მარცხენა პარკუჭის ჰიპერტროფიის განვითარებისთვის. აღნიშნული კვლევა შეიძლება ჩაითვალოს კიდევ ერთ წინ გადადგმულ ნაბიჯად მიოკარდიუმის ჰიპერტროფიის და რემოდელირების პათოგენეზური მექანიზმების კვლევის საქმეში.
Downloads
Houser SR. When does spontaneous sarcoplasmic reticulum Ca2+ release cause a triggered arrhythmia? Cellular versus tissue requirements. Circ Res. 2000;87:725–7.
Mann DL, Bristow MR. Mechanisms and models in heart failure: The biomechanical model and beyond. Circulation. 2005;111:2837–49.
Pogwizd SM, Schlotthauer K, Li L, Yuan WL, Bers DM. Arrhythmogenesis and contractile dysfunction in heart failure - Roles of sodium-calcium exchange, inward rectifier potassium current, and residual beta-adrenergic responsiveness. Circ Res. 2001;88:1159–67.
Sipido KR, Volders PGA, Vos MA, Verdonck F. Altered Na/Ca exchange activity in cardiac hypertrophy and heart failure: a new target for therapy? Cardiovasc Res. 2002;53:782–805. https://animal.research.uiowa.edu/iacuc-guidelines-anesthesia
Bers DM. Cardiac excitation-contraction coupling. Nature. 2002;415:198–205.
Hilgemann DW. New insights into the molecular and cellular workings of the cardiac Na+/Ca2+ exchanger. Am J Physiol. 2004;287:C1167–C1172.
https://academic.oup.com/ilarjournal/article/62/1-2/238/6299201
Reuter H, Pott C, Goldhaber JI, Henderson SA, Philipson KD, Schwinger RHG. Na+-Ca2+exchange in the regulation of cardiac excitation-contraction coupling. Cardiovasc Res. 2005;67:198–207.
Gaughan JP, Furukawa S, Jeevanandam V, Hefner CA, Kubo H, Margulies KB, et al. Sodium/calcium exchange contributes to contraction and relaxation in failed human ventricular myocytes. Amer J Physiol. 1999;277:H714–H724.
Houser SR, Piacentino V, Weisser J. Abnormalities of calcium cycling in the hypertrophied and failing heart. J Mol Cell Cardiol. 2000;32:1595–607.
Terracciano CMN, DeSouza AI, Philipson KD, MacLeod KT. Na+ - Ca2+ exchange and sarcoplasmic reticular Ca2+ regulation in ventricular myocytes overexpressing the Na+ - Ca2+ exchanger. J Physiol London. 1998;512:651–67.
Weisser-Thomas J, Piacentino V, Gaughan JP, Margulies K, Houser SR. Calcium entry via Na/Ca exchange during the action potential directly contributes to contraction of failing human ventricular myocytes. Cardiovasc Res. 2003;57:974–85.
Hampton TG, Wang JF, DeAngelis J, Amende I, Philipson KD, Morgan JP. Enhanced gene expression of Na+/Ca2+ exchanger attenuates ischemic and hypoxic contractile dysfunction. Amer J Physiol. 2000;279:H2846–H2854.
Hobai IA, ORourke B. Enhanced Ca2+-activated Na+-Ca2+ exchange activity in canine pacing-induced heart failure. Circ Res. 2000;87:690–8.
Kent RL, Rozich JD, McCollam PL, McDermott DE, Thacker UF, Menick DR, et al. Rapid expression of the Na+-Ca2+ exchanger in response to cardiac pressure overload - rapid communication. Am J Physiol. 1993;265:H1024–H1029.
Schillinger W, Fiolet JW, Schlotthauer K, Hasenfuss G. Relevance of Na+-Ca2+ exchange in heart failure. Cardiovasc Res. 2003;57:921–33.
Studer R, Reinecke H, Bilger J, Eschenhagen T, Bohm M, Hasenfuss G, et al. Gene expression of the cardiac Na+ - Ca2+ exchanger in end-stage human heart failure. Circ Res. 1994;75:443–53.
Wang ZY, Nolan B, Kutschke W, Hill JA. Na+-Ca2+ exchanger remodeling in pressure overload cardiac hypertrophy. J Biol Chem. 2001;276:17706–11.
Zhang XQ, Song JL, Rothblum LI, Lun MY, Wang XJ, Ding F, et al. Overexpression of Na+/Ca2+ exchanger alters contractility and SR Ca2+ content in adult rat myocytes. Amer J Physiol. 2001;281:H2079–H2088.
Gomez AM, Valdivia HH, Cheng H, Lederer MR, Santana LF, Cannell MB, et al. Defective excitation-contraction coupling in experimental cardiac hypertrophy and heart failure. Science. 1997;276:800–6.
Schultz JEJ, Glascock BJ, Witt SA, Nieman ML, Nattamai KJ, Liu LH, Lorenz JN, et al. Accelerated onset of heart failure in mice during pressure overload with chronically decreased SERCA2 calcium pump activity. Am J Physiol. 2004;286:H1146–H1153.
Petit-Demouliere B, Chenu F, Bourin M. Forced swimming test in mice: a review of antidepressant activity. Psychopharmacology. (Berl) 2005;177:245–255.
David DJ, Renard CE, Jolliet P, Hascoet M, Bourin M. Antidepressant-like effects in various mice strains in the forced swimming test. Psychopharmacology (Berl) 2003;166:373–382.

ეს ნამუშევარი ლიცენზირებულია Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 საერთაშორისო ლიცენზიით .