FOXP3+ ექსპრესიის თავისებურებები ენდომეტრიუმის სიმსივნისწინარე და სიმსივნურ დაზიანებებში: იმუნური მიკროგარემოს დინამიკის შედარებითი კვლევა
ჩამოტვირთვები
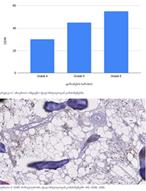
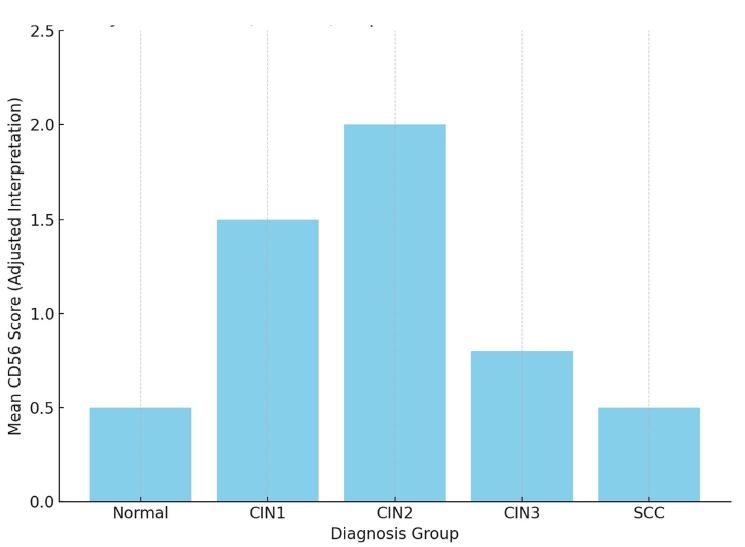
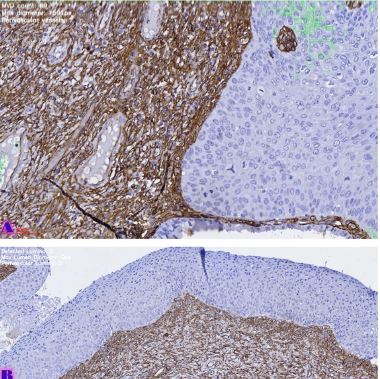
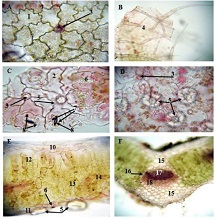
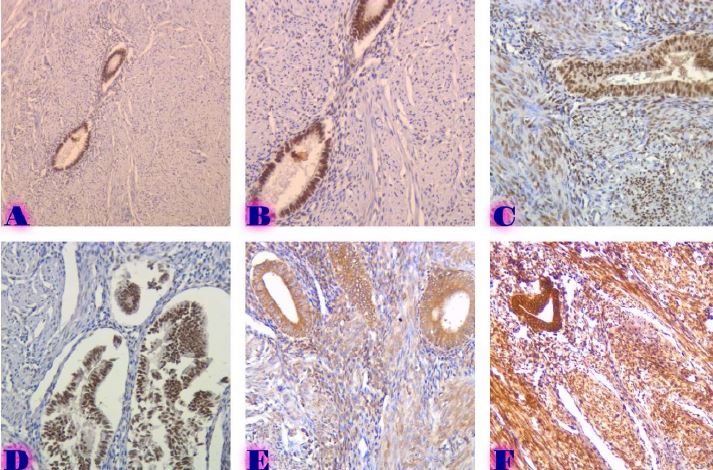
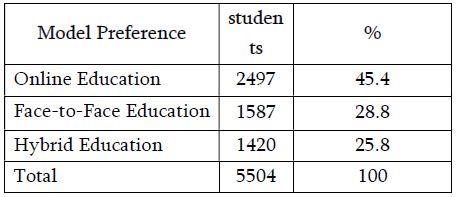
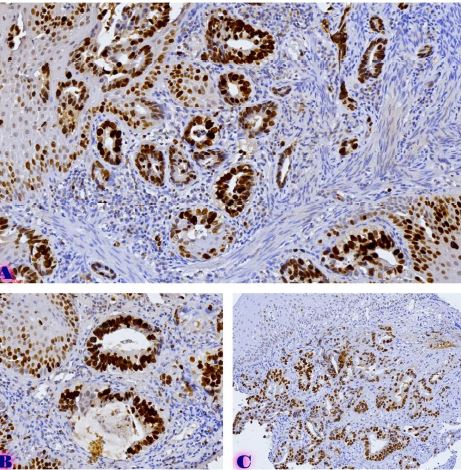
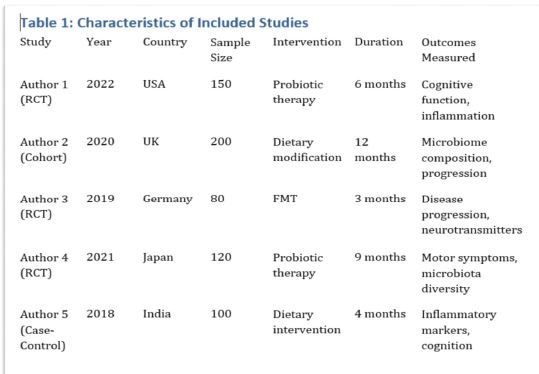
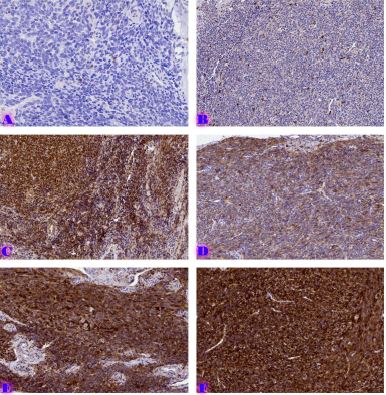
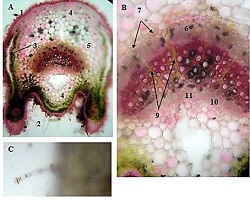
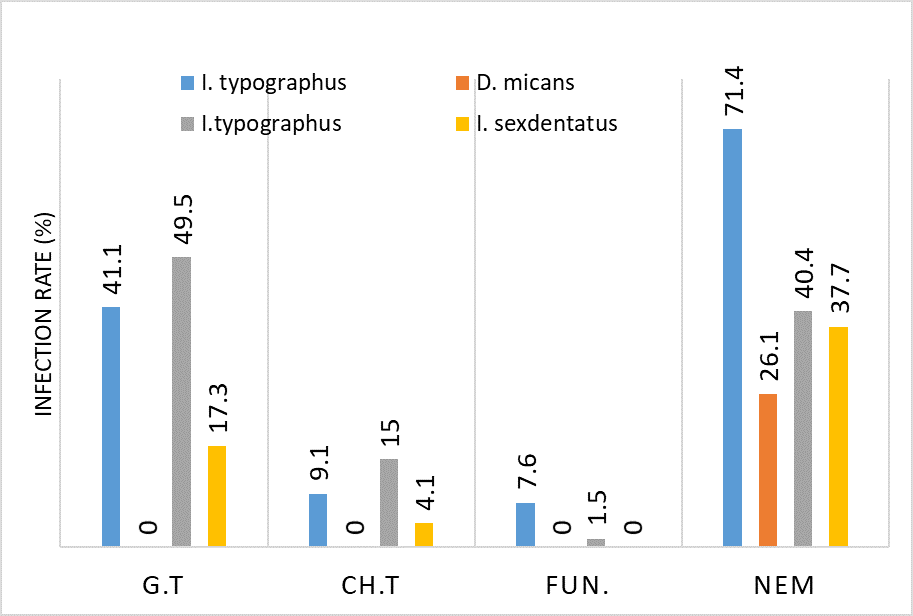
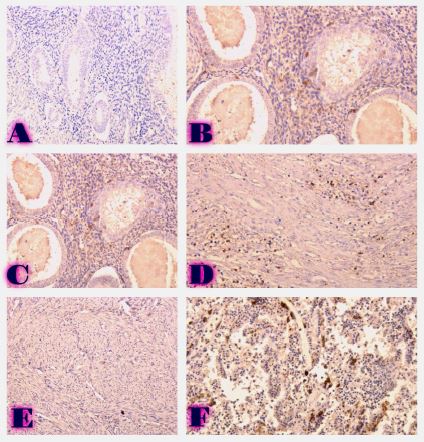
ენდომეტრიუმის კარცინომა არის ქალთა პოპულაციაში კიბოსთან დაკავშირებული სიკვდილიანობის წამყვანი მიზეზი, სხვადასხვა ჰისტოლოგიური ქვეტიპები, როგორიცაა ენდომეტროიდული და სეროზული კარცინომა, ავლენს განსხვავებულ კლინიკურ ქცევას. მარეგულირებელი T უჯრედები (Tregs), რომლებიც აღინიშნება FOXP3 ექსპრესიით, ცნობილია, რომ გადამწყვეტ როლს ასრულებს სიმსივნის მიკროგარემოს იმუნურ მოდულაციაში. პროგრამირებული უჯრედის სიკვდილის ლიგანდი 1 (PDL1) არის კიდევ ერთი საკვანძო იმუნური გამშვები პუნქტის მოლეკულა, რომელიც სხვადასხვა ავთვისებიან სიმსივნეში დაკავშირებულია იმუნური სისტემისაგან სიმსივნური უჯრედების თავის არიდებასთან. ჩვენი კვლევის მიზანს წარმოადგენს გამოვავლინოთ FOXP3 და PDL1-ის ექსპრესიის თავისებურებები ენდომეტრიუმის კეთილთვისებიან და ავთვისებიან დაზიანებებში. კვლევაში ჩართული იყო ჯამში 150 შემთხვევა. FOXP3 და PDL1 ექსპრესია შეფასდა იმუნოჰისტოქიმიის გამოყენებით და ჩატარდა სტატისტიკური ანალიზი ამ მარკერებსა და კლინიკო-პათოლოგიურ მახასიათებლებს შორის კორელაციის შესაფასებლად, როგორიცაა ასაკი, სიმსივნის სტადია და ჰისტოლოგიური ქვეტიპი. კვლევამ აჩვენა, რომ FOXP3 ექსპრესია მნიშვნელოვნად მაღალი იყო ავთვისებიან დაზიანებებში (საშუალოდ 22-30%) კეთილთვისებიან ჰიპერპლაზიებთან შედარებით (საშუალოდ 5%). სეროზული კარცინომის შემთხვევებში გამოვლინდა ყველაზე მაღალი FOXP3 ექსპრესია (30%), რასაც მოჰყვა ენდომეტროიდული კარცინომა (22%). დაფიქსირდა დადებითი კორელაცია FOXP3 და PDL1 ექსპრესიას შორის (Spearman-ის კორელაციის კოეფიციენტი = 0.75, p<0.001). გარდა ამისა, უფრო მაღალი FOXP3 და PDL1 ექსპრესია დაფიქსირდა მაღალი სტადიის სიმსივნეებში (pT2) ადრეულ სტადიის სიმსივნეებთან შედარებით (pT1). პოზიტიური კორელაცია FOXP3 და PDL1 ესპრესიას შორის მიუთითებს იმუნური აცილების პოტენციურ მექანიზმზე და მხარს უჭერს იმუნური გამშვები პუნქტის ინჰიბიტორების გამოყენებას, როგორც თერაპიულ სტრატეგიას ენდომეტრიუმის კარცინომის შემთხვევებში.
Downloads
A. S. Uduwela, M. A. K. Perera, L. Aiqing, and I. S. Fraser, “Endometrial-myometrial interface: Relationship to adenomyosis and changes in pregnancy,” Obstet Gynecol Surv, vol. 55, no. 6, pp. 390–400, Jun. 2000, doi: 10.1097/00006254-200006000-00025.
P. Morice, A. Leary, C. Creutzberg, N. Abu-Rustum, and E. Darai, “Endometrial cancer,” The Lancet, vol. 387, no. 10023, pp. 1094–1108, Mar. 2016, doi: 10.1016/S0140-6736(15)00130-0.
C. Casas-Arozamena and M. Abal, “Endometrial Tumour Microenvironment,” Adv Exp Med Biol, vol. 1296, pp. 215–225, 2020, doi: 10.1007/978-3-030-59038-3_13.
G. D’Andrilli, A. Bovicelli, M. G. Paggi, and A. Giordano, “New insights in endometrial carcinogenesis,” J Cell Physiol, vol. 227, no. 7, pp. 2842–2846, Jul. 2012, doi: 10.1002/jcp.24016.
A. Markowska, M. Pawałowska, J. Lubin, and J. Markowska, “Signalling pathways in endometrial cancer,” Wspolczesna Onkologia, vol. 18, no. 3, pp. 143–148, 2014, doi: 10.5114/WO.2014.43154.
P. Zhorzholiani, Z. Bokhua, S. Kepuladze, and G. Burkadze, “The Role of M1 and M2 Macrophages in the Progression of Endometrial Hyperplasia to Endometrioid Adenocarcinoma,” ქართველი მეცნიერები, vol. 7, no. 1, pp. 24–37, Jan. 2025, doi: 10.52340/gs.2025.07.01.04.
M. Arafat Hossain, “A comprehensive review of immune checkpoint inhibitors for cancer treatment,” Int Immunopharmacol, vol. 143, no. Pt 2, Dec. 2024, doi: 10.1016/J.INTIMP.2024.113365.
Y. Wang and B. P. Zhou, “Epithelial-mesenchymal transition in breast cancer progression and metastasis,” Chin J Cancer, vol. 30, no. 9, p. 603, 2011, doi: 10.5732/CJC.011.10226.
L. Uroog, A. H. Rahmani, M. A. Alsahli, S. A. Almatroodi, R. A. Wani, and M. Moshahid Alam Rizvi, “Genetic Profile of FOXO3 Single-Nucleotide Polymorphism in Colorectal Cancer Patients,” Oncology (Switzerland), vol. 102, no. 4, pp. 299–309, Oct. 2023, doi: 10.1159/000533729/867502/GENETIC-PROFILE-OF-FOXO3-SINGLE-NUCLEOTIDE.
S. Sakaguchi, T. Yamaguchi, T. Nomura, and M. Ono, “Regulatory T cells and immune tolerance,” Cell, vol. 133, no. 5, pp. 775–787, May 2008, doi: 10.1016/J.CELL.2008.05.009.
D. Tan, Y. Fu, W. Tong, and F. Li, “Prognostic significance of lymphocyte to monocyte ratio in colorectal cancer: A meta-analysis,” International Journal of Surgery, vol. 55, pp. 128–138, Jul. 2018, doi: 10.1016/J.IJSU.2018.05.030.
S. L. Topalian et al., “Safety, activity, and immune correlates of anti-PD-1 antibody in cancer,” N Engl J Med, vol. 366, no. 26, pp. 2443–2454, Jun. 2012, doi: 10.1056/NEJMOA1200690.
R. Saleh and E. Elkord, “FoxP3+ T regulatory cells in cancer: Prognostic biomarkers and therapeutic targets,” Cancer Lett, vol. 490, pp. 174–185, Oct. 2020, doi: 10.1016/J.CANLET.2020.07.022.
Y. Ohue and H. Nishikawa, “Regulatory T (Treg) cells in cancer: Can Treg cells be a new therapeutic target?,” Cancer Sci, vol. 110, no. 7, pp. 2080–2089, Jul. 2019, doi: 10.1111/CAS.14069.
საავტორო უფლებები (c) 2025 ქართველი მეცნიერები

ეს ნამუშევარი ლიცენზირებულია Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 საერთაშორისო ლიცენზიით .