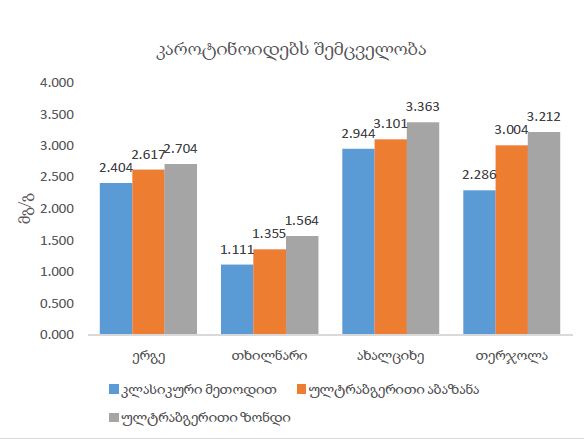
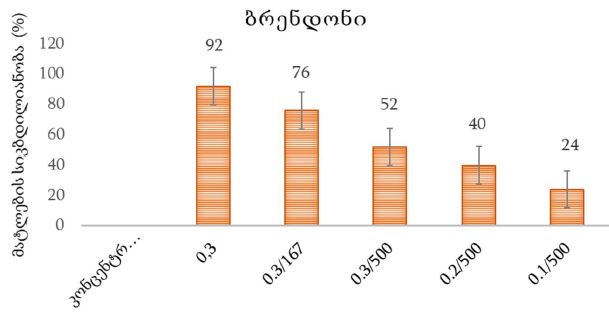
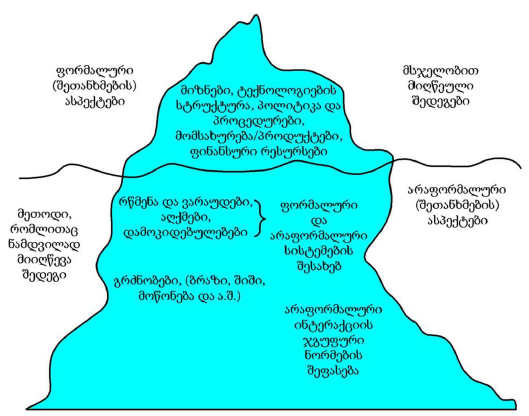
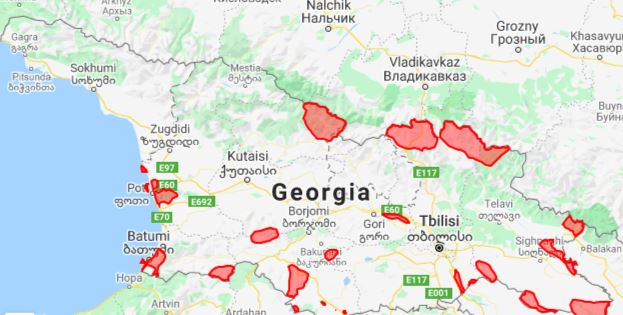
რევმატოიდული გონართრიტის პროლიფერაციულ-აპოპტოზური, ჰორმონული რეცეპტორებისა და იმუნური პასუხის თავისებურებების შესწავლის პრობლემური საკითხები
ჩამოტვირთვები
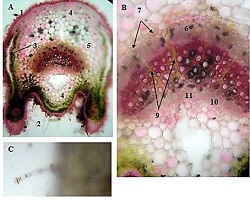
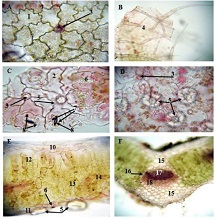
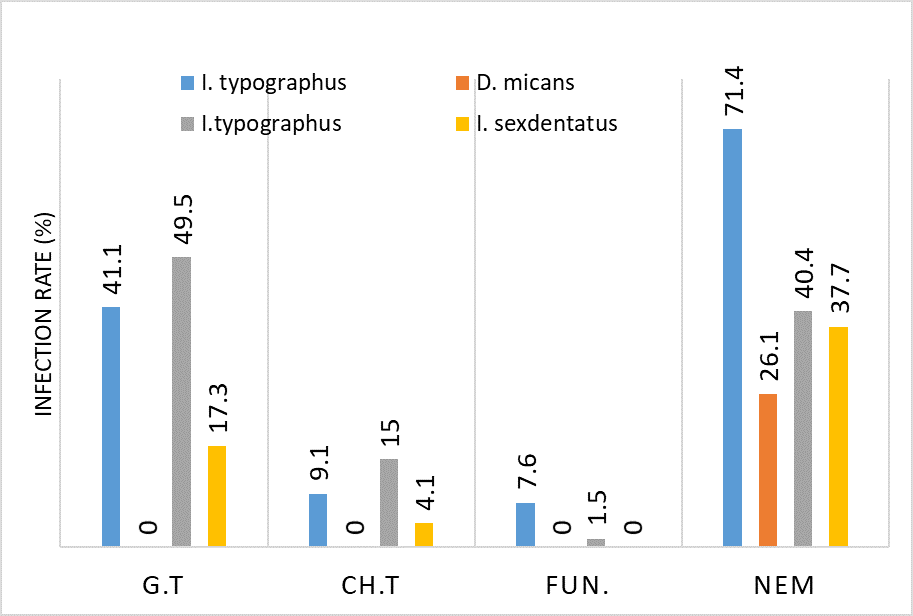
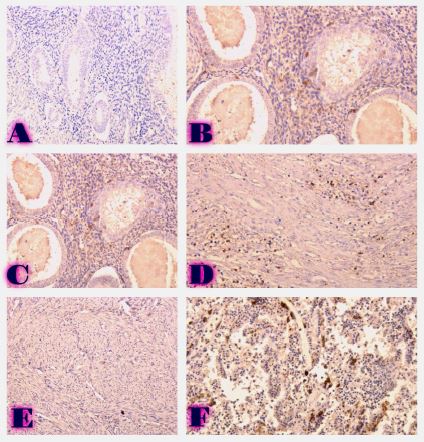
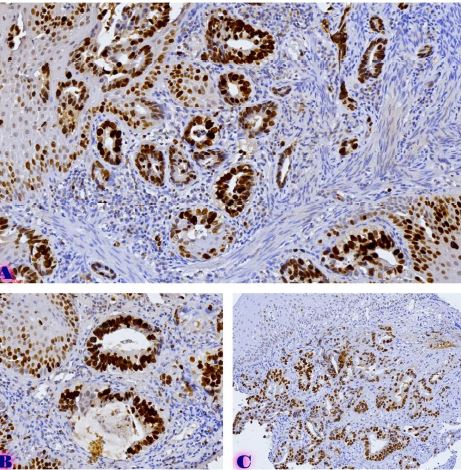
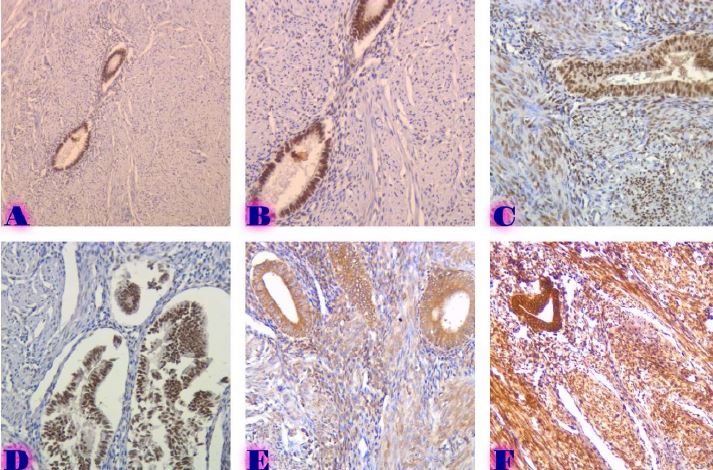
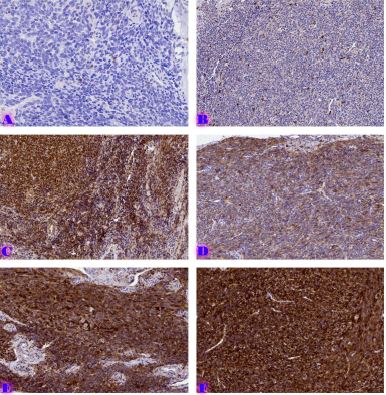
რევმატოიდული ართრიტი (RA) არის უცნობი ეტიოლოგიის მულტიფაქტორული აუტოიმუნური მექანიზმებით მიმდინარე დაავადებაა, რომელიც ძირითადად აზიანებს სახსრებს, თუმცა, შესაძლოა, გამოვლინდეს ექსტრაარტიკულური ცვლილებები. რევმატოიდული ართრიტის განვითარების პათოგენეზური მექანიზმი სრულად არ არის შესწავლილი, რაც მოითხოვს კვლევების შემდგომ გაგრძელებას. მიუხედავად იმისა, რომ სინოვიური გარსი არის ართრიტის ძირითადი სამიზნე, სინოვიური ქსოვილის სპეციფიკური ანტიგენები, რომლებმაც შეიძლება გამოიწვიონ იმუნური პასუხი, პრაქტიკულად უცნობია. სინოვიური გარსის შესწავლის ერთ-ერთი ყველაზე მნიშვნელოვანი მიზეზი არის იმ იმუნოპათოლოგიური პროცესების გამოვლენა, რომლებიც შესაძლოა გამოყენებულ იქნეს თერაპიულ სამიზნედ და შედეგების პროგნოზირებისთვის. რევმატოიდული ართრიტის პათოლოგიურ ნიშანს წარმოადგენს ძვლის კარგვა, რომელიც გამოიხატება ლოკალური, პერიარტიკულური და სისტემური ძვლის ქსოვილის შემცირებაში და წარმოადგენს ოსტეოკლასტების ინდუქციისა და ოსტეობლასტების სუპრესიის შედეგს. არის თუ არა ანთება, ან აუტოიმუნური მექანიზმი ძვლის დაზიანების მთავარი ფაქტორი, საკამათო საკითხია.
Downloads
A. Mathiessen and P. G. Conaghan, “Synovitis in osteoarthritis: current understanding with therapeutic implications.,” Arthritis Res Ther, vol. 19, no. 1, p. 18, Feb. 2017, doi: 10.1186/s13075-017-1229-9.
E. B. P. Lopes, A. Filiberti, S. A. Husain, and M. B. Humphrey, “Immune Contributions to Osteoarthritis.,” Curr Osteoporos Rep, vol. 15, no. 6, pp. 593–600, Dec. 2017, doi: 10.1007/s11914-017-0411-y.
E. Sanchez-Lopez, R. Coras, A. Torres, N. E. Lane, and M. Guma, “Synovial inflammation in osteoarthritis progression.,” Nat Rev Rheumatol, vol. 18, no. 5, pp. 258–275, May 2022, doi: 10.1038/s41584-022-00749-9.
Y.-J. Lin, M. Anzaghe, and S. Schülke, “Update on the Pathomechanism, Diagnosis, and Treatment Options for Rheumatoid Arthritis.,” Cells, vol. 9, no. 4, Apr. 2020, doi: 10.3390/cells9040880.
A. Najm et al., “Correction to: Standardisation of synovial biopsy analyses in rheumatic diseases: a consensus of the EULAR Synovitis and OMERACT Synovial Tissue Biopsy Groups.,” Arthritis Res Ther, vol. 20, no. 1, p. 282, Dec. 2018, doi: 10.1186/s13075-018-1795-5.
J. Hirose, H. Nishioka, M. Tsukano, S. Matsubara, K. Usuku, and H. Mizuta, “Matrix changes in articular cartilage in the knee of patients with rheumatoid arthritis after biological therapy: 1-year follow-up evaluation by T2 and T1ρ MRI quantification.,” Clin Radiol, vol. 73, no. 11, pp. 984.e11-984.e18, Nov. 2018, doi: 10.1016/j.crad.2018.06.020.
U. Harre and G. Schett, “[Association between bone catabolism and anti-citrullinated protein antibodies in rheumatoid arthritis].,” Z Rheumatol, vol. 75, no. 8, pp. 809–811, Oct. 2016, doi: 10.1007/s00393-016-0149-4.
J. C. Mora, R. Przkora, and Y. Cruz-Almeida, “Knee osteoarthritis: pathophysiology and current treatment modalities.,” J Pain Res, vol. 11, pp. 2189–2196, 2018, doi: 10.2147/JPR.S154002.
G. S. Dulay, C. Cooper, and E. M. Dennison, “Knee pain, knee injury, knee osteoarthritis & work.,” Best Pract Res Clin Rheumatol, vol. 29, no. 3, pp. 454–61, Jun. 2015, doi: 10.1016/j.berh.2015.05.005.
Q. Guo, Y. Wang, D. Xu, J. Nossent, N. J. Pavlos, and J. Xu, “Rheumatoid arthritis: pathological mechanisms and modern pharmacologic therapies.,” Bone Res, vol. 6, p. 15, 2018, doi: 10.1038/s41413-018-0016-9.
T. Pap and A. Korb-Pap, “Cartilage damage in osteoarthritis and rheumatoid arthritis--two unequal siblings.,” Nat Rev Rheumatol, vol. 11, no. 10, pp. 606–15, Oct. 2015, doi: 10.1038/nrrheum.2015.95.
A. Sergijenko, A. J. Roelofs, A. H. K. Riemen, and C. De Bari, “Bone marrow contribution to synovial hyperplasia following joint surface injury.,” Arthritis Res Ther, vol. 18, p. 166, Jul. 2016, doi: 10.1186/s13075-016-1060-8.
M. D. Wechalekar and M. D. Smith, “Utility of arthroscopic guided synovial biopsy in understanding synovial tissue pathology in health and disease states.,” World J Orthop, vol. 5, no. 5, pp. 566–73, Nov. 2014, doi: 10.5312/wjo.v5.i5.566.
P. Luo et al., “The Role of Autophagy in Chondrocyte Metabolism and Osteoarthritis: A Comprehensive Research Review.,” Biomed Res Int, vol. 2019, p. 5171602, 2019, doi: 10.1155/2019/5171602.
O. Alvarez-Garcia, T. Matsuzaki, M. Olmer, L. Plate, J. W. Kelly, and M. K. Lotz, “Regulated in Development and DNA Damage Response 1 Deficiency Impairs Autophagy and Mitochondrial Biogenesis in Articular Cartilage and Increases the Severity of Experimental Osteoarthritis.,” Arthritis Rheumatol, vol. 69, no. 7, pp. 1418–1428, Jul. 2017, doi: 10.1002/art.40104.
W. Waldstein, G. Perino, S. L. Gilbert, S. A. Maher, R. Windhager, and F. Boettner, “OARSI osteoarthritis cartilage histopathology assessment system: A biomechanical evaluation in the human knee.,” J Orthop Res, vol. 34, no. 1, pp. 135–40, Jan. 2016, doi: 10.1002/jor.23010.
K. Okamoto et al., “Osteoimmunology: The Conceptual Framework Unifying the Immune and Skeletal Systems.,” Physiol Rev, vol. 97, no. 4, pp. 1295–1349, Oct. 2017, doi: 10.1152/physrev.00036.2016.
S. Garcia et al., “Colony-stimulating factor (CSF) 1 receptor blockade reduces inflammation in human and murine models of rheumatoid arthritis.,” Arthritis Res Ther, vol. 18, p. 75, Mar. 2016, doi: 10.1186/s13075-016-0973-6.
B. Wang et al., “IL-34 Upregulated Th17 Production through Increased IL-6 Expression by Rheumatoid Fibroblast-Like Synoviocytes,” Mediators Inflamm, vol. 2017, pp. 1–10, 2017, doi: 10.1155/2017/1567120.
S.-L. Wang, R. Zhang, K.-Z. Hu, M.-Q. Li, and Z.-C. Li, “Interleukin-34 Synovial Fluid Was Associated with Knee Osteoarthritis Severity: A Cross-Sectional Study in Knee Osteoarthritis Patients in Different Radiographic Stages.,” Dis Markers, vol. 2018, p. 2095480, 2018, doi: 10.1155/2018/2095480.
A. H. Hegaze, A. S. Hamdi, A. Alqrache, and M. Hegazy, “Efficacy of Platelet-Rich Plasma on Pain and Function in the Treatment of Knee Osteoarthritis: A Prospective Cohort Study.,” Cureus, vol. 13, no. 3, p. e13909, Mar. 2021, doi: 10.7759/cureus.13909.
საავტორო უფლებები (c) 2023 ქართველი მეცნიერები

ეს ნამუშევარი ლიცენზირებულია Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 საერთაშორისო ლიცენზიით .