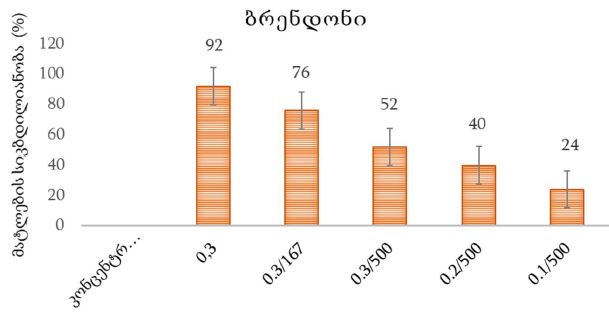
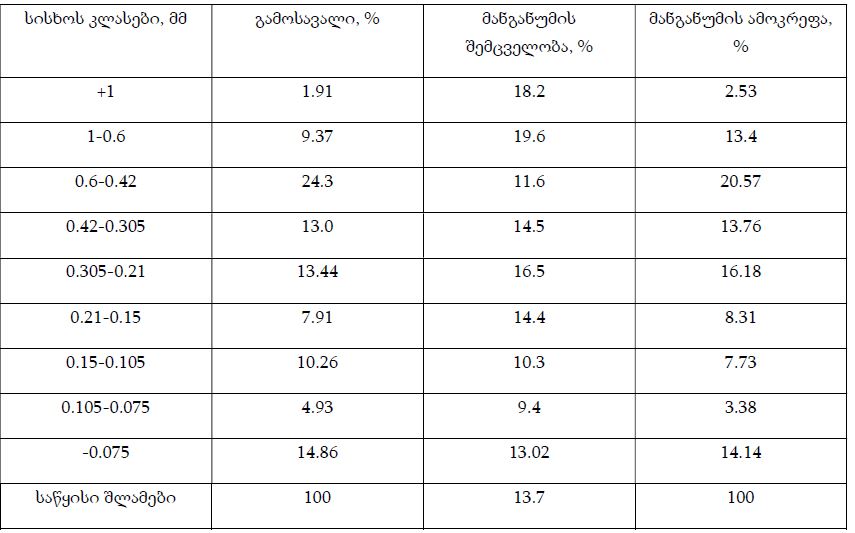
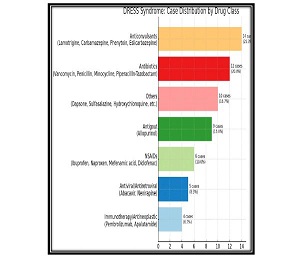
CAR-T უჯრედების იმუნოთერაპიაში გამოყენების თავისებურებებისა და გამოწვევების ზოგიერთი საკითხის სამეცნიერო განხილვა
ჩამოტვირთვები
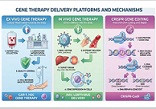
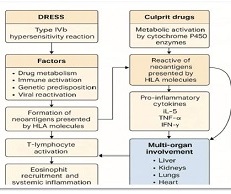
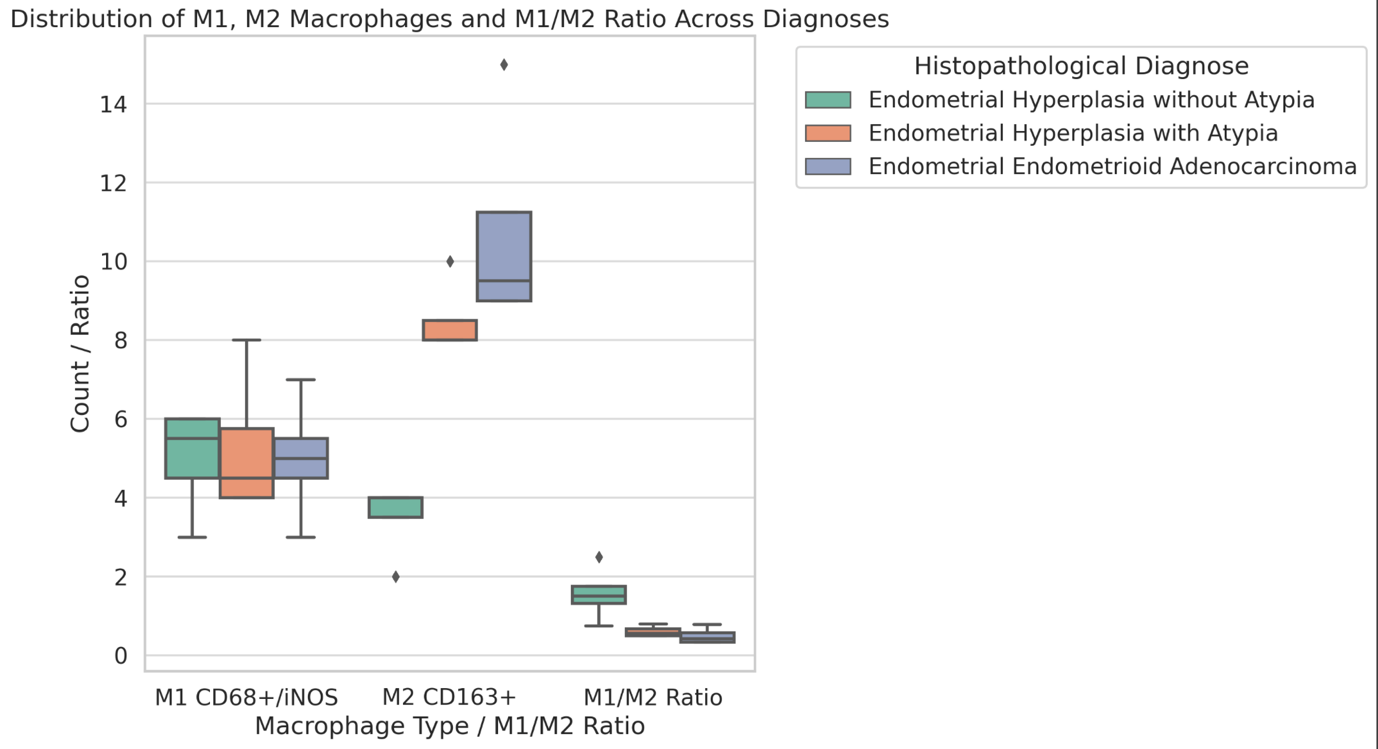
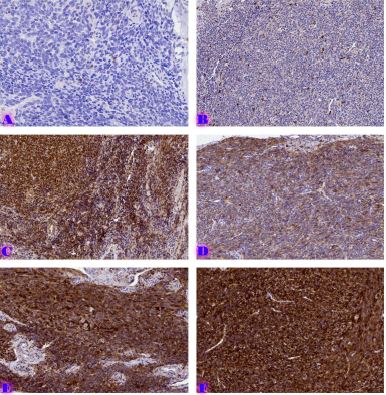
კვლევის მიზანი იყო იმუნოთერაპიაში CAR-T უჯრედების გამოყენების თავისებურებების ზოგიერთი საკითხის შესწავლა და ანალიზი. CAR-T უჯრედების პროდუქტების დახასიათება მოიცავს მათი ფენოტიპის, გენოტიპის და ფუნქციური ატრიბუტების შეფასებას ისეთი ტექნიკის გამოყენებით, როგორიცაა ნაკადის ციტომეტრია, PCR-ზე დაფუძნებული ანალიზი და ციტოტოქსიკურობის ანალიზი. გრძელვადიანი სტაბილურობის კვლევები აფასებს CAR-T უჯრედების სიცოცხლისუნარიანობას, პოტენციალს და ციტოკინის სეკრეციის პროფილებს შენახვის სხვადასხვა პირობებში შენახვის ვადის დასადგენად და პროდუქტის ლოგისტიკის გასაადვილებლად. ბიომარკერები კიბოს იმუნოთერაპიის სფეროში გადამწყვეტ ინსტრუმენტებად გვევლინება, რაც ხელს უწყობს პაციენტის შერჩევასა და მკურნალობის ოპტიმიზაციას. ქიმერული ანტიგენური რეცეპტორების CAR-T უჯრედების თერაპიის კონტექსტში, ბიომარკერები მნიშვნელოვან როლს ასრულებენ მკურნალობის პასუხის პროგნოზირებაში, პოტენციური ტოქსიკურობის იდენტიფიცირებაში და პერსონალიზებული მკურნალობის მიდგომების წარმართვაში. პროგნოზირებადი ბიომარკერები CAR-T უჯრედების თერაპიაში, ჩვეულებრივ, ორიენტირებულია სიმსივნის ანტიგენის ექსპრესიის პროფილებზე. სამიზნე ანტიგენების შერჩევა გადამწყვეტ როლს თამაშობს მკურნალობის შედეგებში, გამოხატვის უფრო მაღალი და თანმიმდევრული დონეები კორელაციაშია უკეთესი რეაგირების მაჩვენებლებთან. სიმსივნის მიკროგარემო (TME) მნიშვნელოვნად მოქმედებს CAR-T უჯრედების აქტივობაზე. ბიომარკერები, რომლებიც ასახავს TME მახასიათებლებს, როგორიცაა იმუნური უჯრედების ინფილტრაცია, ციტოკინის პროფილები და ინჰიბიტორული მოლეკულების ექსპრესია, ასახავს ინფორმაციას TME-ის იმუნოსუპრესიული ბუნების და მისი ეფექტების შესახებ CAR-T უჯრედების ეფექტურობაზე. ანთებითი TME-ის მქონე პაციენტები, რომლებიც აღინიშნება უხვი ეფექტური T უჯრედებით და ინჰიბიტორული მოლეკულების დაბალი ექსპრესიით, როგორიცაა PD-L1, უკეთესად რეაგირებენ CAR-T უჯრედების თერაპიაზე. CAR-T უჯრედები ავლენენ სიმსივნეების ერიდიკაციის ეფექტებს, სადაც მიმდებარე სიმსივნური უჯრედები სამიზნე ანტიგენის გარეშე აღმოიფხვრება ფენომენის საშუალებით, რომელსაც ეწოდება ანტიგენის გავრცელება. ეს პროცესი გამოწვეულია ციტოკინების გამონთავისუფლებით და სიმსივნური ანტიგენების წარმომადგენლობითი უჯრედებით (APCs), რის შედეგადაც ხდება სხეულის საკუთარი იმუნური ეფექტის მქონე უჯრედების გააქტიურება სიმსივნური უჯრედების წინააღმდეგ. CAR-T უჯრედები ავლენენ ძლიერ ანტისიმსივნურ შესაძლებლობებს, მათ შეუძლიათ წინააღმდეგობის მექანიზმების წინაშე აღმოჩნდნენ სიმსივნის მიკროგარემოში. იმუნოსუპრესიული უჯრედების პოპულაციები, როგორიცაა მარეგულირებელი T უჯრედები (Tregs) და მიელოიდური წარმოშობის სუპრესორული უჯრედები (MDSCs), ასევე ინჰიბიტორული ციტოკინები, როგორიცაა ტრანსფორმირებადი ზრდის ფაქტორი-ბეტა (TGF-β) და ინტერლეუკინ-10 (IL-10). რეზისტენტობის მექანიზმები და სტრატეგიები მოიცავს კომბინირებული თერაპიის გამოყენებას იმუნური ცენტრების ინჰიბიტორებით, ციტოკინის მოდულატორებით და მიზნობრივი თერაპიებით, რომლებიც მიზნად ისახავს იმუნოსუპრესიული გზების დარღვევას. CAR-T უჯრედების თერაპიამ მოახდინა რევოლუცია კიბოს მკურნალობაში, იმუნური სისტემის ძალის გამოყენებით სიმსივნური უჯრედების მიზანმიმართულობისა და ლიკვიდაციის მიზნით.
Downloads
Gross, G., Waks, T., & Eshhar, Z. (1989). Expression of immunoglobulin-T-cell receptor chimeric molecules as functional receptors with antibody-type specificity. Proceedings of the National Academy of Sciences, 86(24), 10024–10028.
Levine, B. L., Miskin, J., Wonnacott, K., Keir, C., & Global, L. (2016). Global manufacturing of CAR T cell therapy. Molecular Therapy – Methods & Clinical Development, 4, 92–101.
Lai, Y., Weng, J., Wei, X., Qin, L., Lai, P., Zhao. (2018). Toll-like receptor 2 costimulation potentiates the antitumor efficacy of CAR T cells. Leukemia, 32(3), 801–808.
Guedan, S., Calderon, H., Posey, M. V., & June, C. H. (2019). Engineering and Design of Chimeric Antigen Receptors. Molecular Therapy – Methods & Clinical Development, 12, 145–156.
Ren, J., Zhang, X., Liu, X., Fang, C., Jiang, S., June, C. H., & Zhao, Y. (2017). A Versatile System for Rapid Multiplex Genome-edited CAR T Cell Generation. Oncotarget, 8(10), 17002–17011.
June, C. H., & Sadelain, M. (2018). Chimeric Antigen Receptor Therapy. New England Journal of Medicine, 379(1), 64–73.
Zah, E., Lin, M. Y., Silva-Benedict, A., Jensen, M. C., & Chen, Y. Y. (2016). T Cells Expressing CD19/CD20 Bispecific Chimeric Antigen Receptors Prevent Antigen Escape by Malignant B Cells. Cancer Immunology Research, 4(6), 498–508.
Fesnak, A. D., June, C. H., & Levine, B. L. (2016). Engineered T cells: The promise and challenges of cancer immunotherapy. Nature Reviews Cancer, 16(9), 566–581.
Maus, M. V., & June, C. H. (2016). Making Better Chimeric Antigen Receptors for Adoptive T-cell Therapy. Clinical Cancer Research, 22(8), 1875–1884.
Guedan, S., Calderon, H., Posey, A. D., & June, C. H. (2019). Engineering and Design of Chimeric Antigen Receptors. Molecular Therapy – Methods & Clinical Development, 12, 145–156.
Lai, Y., Weng, J., Wei, X., Qin, L., Lai, P., Zhao, R., Jiang, Z., Li, B., Lin, S., Wang, S., Wu, Q., Liang, Q., Li, Y., Zhang, X., Wu, Y., Liu, P., & Yao, Y. (2018). Toll-like receptor 2 costimulation potentiates the antitumor efficacy of CAR T cells. Leukemia, 32(3), 801–808.
Ren, J., Zhang, X., Liu, X., Fang, C., Jiang, S., June, C. H., & Zhao, Y. (2017). A Versatile System for Rapid Multiplex Genome-edited CAR T Cell Generation. Oncotarget, 8(10), 17002–17011.
Guedan, S., Calderon, H., Posey, A. D., Maus, M. V., & June, C. H. (2019). Engineering and Design of Chimeric Antigen Receptors. Molecular Therapy – Methods & Clinical Development, 12, 145–156.
Levine, B. L., Miskin, J., Wonnacott, K., Keir, C., & Global, L. (2016). Global manufacturing of CAR T cell therapy. Molecular Therapy – Methods & Clinical Development, 4, 92–101.
Gross, G., Waks, T., & Eshhar, Z. (1989). Expression of immunoglobulin-T-cell receptor chimeric molecules as functional receptors with antibody-type specificity. Proceedings of the National Academy of Sciences, 86(24), 10024–10028.
Zah, E., Lin, M. Y., Silva-Benedict, A., Jensen, M. C., & Chen, Y. Y. (2016). T Cells Expressing CD19/CD20 Bispecific Chimeric Antigen Receptors Prevent Antigen Escape by Malignant B Cells. Cancer Immunology Research, 4(6), 498–508.
Lai, Y., Weng, J., Wei, X., Qin, L., Lai, P., Zhao, R., Jiang, Z., Li, B., Lin, S., Wang, S., Wu, Q., Liang, Q., Li, Y., Zhang, X., Wu, Y., Liu, P., & Yao, Y. (2018). Toll-like receptor 2 costimulation potentiates the antitumor efficacy of CAR T cells. Leukemia, 32(3), 801–808.
Maus, M. V., & June, C. H. (2016). Making Better Chimeric Antigen Receptors for Adoptive T-cell Therapy. Clinical Cancer Research, 22(8), 1875–1884.
June, C. H., & Sadelain, M. (2018). Chimeric Antigen Receptor Therapy. New England Journal of Medicine, 379(1), 64–73.
Zah, E., Lin, M. Y., Silva-Benedict, A., Jensen, M. C., & Chen, Y. Y. (2016). T Cells Expressing CD19/CD20 Bispecific Chimeric Antigen Receptors Prevent Antigen Escape by Malignant B Cells. Cancer Immunology Research, 4(6), 498–508.
Maude, S. L., & Laetsch, T. W. (2018). Tisagenlecleucel in Children and Young Adults with B-Cell Lymphoblastic Leukemia. New England Journal of Medicine, 378(5), 439–448.
Schuster, S. J., & Bishop, M. R. (2019). Tisagenlecleucel in Adult Relapsed or Refractory Diffuse Large B-Cell Lymphoma. New England Journal of Medicine, 380(1), 45–56.
Locke, F. L., & Ghobadi, A. (2019). Long-term Safety and Activity of Axicabtagene Ciloleucel in Refractory Large B-cell Lymphoma (ZUMA-1): A Single-arm, Multicentre, Phase 1–2 Trial. The Lancet Oncology, 20(1), 31–42.
Neelapu, S. S., & Locke, F. L. (2017). Axicabtagene Ciloleucel CAR T-Cell Therapy in Refractory Large B-Cell Lymphoma. New England Journal of Medicine, 377(26), 2531–2544.
Munshi, N. C., & Anderson, L. D., Jr. (2021). Idecabtagene Vicleucel in Relapsed and Refractory Multiple Myeloma. New England Journal of Medicine, 384(8), 705–716.
Madduri, D., & Berdeja, J. G. (2021). Ciltacabtagene Autoleucel, a B-Cell Maturation Antigen–Directed Chimeric Antigen Receptor T-Cell Therapy in Patients with Relapsed or Refractory Multiple Myeloma (CARTITUDE-1): A Phase 1b/2 Open-label Study. The Lancet, 398(10297), 314–324.
Brown, C. E., & Alizadeh, D. (2016). Regression of Glioblastoma after Chimeric Antigen Receptor T-Cell Therapy. New England Journal of Medicine, 375(26), 2561–2569.
Beatty, G. L., & O'Hara, M. H. (2019). Activity of Mesothelin-Specific Chimeric Antigen Receptor T Cells against Pancreatic Carcinoma Metastases. Gastroenterology, 155(1), 29–32.
Schuster, S. J., & Svoboda, J. (2017). Chimeric Antigen Receptor T Cells in Refractory B-Cell Lymphomas. New England Journal of Medicine, 377(26), 2545–2554.
Abramson, J. S., & Palomba, M. L. (2020). Lisocabtagene Maraleucel for Patients with Relapsed or Refractory Large B-Cell Lymphomas (TRANSCEND NHL 001): A Multicentre Seamless Design Study. The Lancet, 396(10254), 839–852.
Teachey, D. T., & Lacey, S. F. (2016). Cytokine release syndrome after chimeric antigen receptor T cell therapy for acute lymphoblastic leukemia. Critical Care Medicine, 44(1), 225–234.
Lee, D. W., & Kochenderfer, J. N. (2015). Cytokine release syndrome in cancer immunotherapy. Cytokine & Growth Factor Reviews, 24(3), 127–134.
Davila, M. L., & Brentjens, R. J. (2011). CD19-Targeted CAR T cells as novel cancer immunotherapy for relapsed or refractory B-cell acute lymphoblastic leukemia. Clinical Cancer Research, 17(6), 1452–1460.
Maude, S. L., & Barrett, D. M. (2014). Managing cytokine release syndrome associated with novel T cell-engaging therapies. Cancer Journal, 20(2), 119–122.
Neelapu, S. S., & Tummala, S. (2018). Chimeric antigen receptor T-cell therapy — assessment and management of toxicities. Nature Reviews Clinical Oncology, 15(1), 47–62.
Santomasso, B. D., & Park, J. H. (2018). Clinical and biological correlates of neurotoxicity associated with CAR T-cell therapy in patients with B-cell acute lymphoblastic leukemia. Cancer Discovery, 8(8), 958–971.
Brudno, J. N., & Kochenderfer, J. N. (2016). Toxicities of chimeric antigen receptor T cells: recognition and management. Blood, 127(26), 3321–3330.
Gust, J., & Taraseviciute, A. (2017). Endothelial Activation and Blood-Brain Barrier Disruption in Neurotoxicity after Adoptive Immunotherapy with CD19 CAR-T Cells. Cancer Discovery, 7(12), 1404–1419.
Ahmed, N., & Brawley, V. S. (2015). Human Epidermal Growth Factor Receptor 2 (HER2) -Specific Chimeric Antigen Receptor-Modified T Cells for the Immunotherapy of HER2-Positive Sarcoma. Journal of Clinical Oncology, 33(15), 1688–1696.
Di Stasi, A., & Tey, S. K. (2011). Inducible apoptosis as a safety switch for adoptive cell therapy. New England Journal of Medicine, 365(18), 1673–1683.
Chmielewski, M., & Hombach, A. (2014). Abstraction and targeting of CD133+ Cancer Stem Cells by Bispecific Epitope-Targeting Receptor Redirected T Cells. Cancer Research, 73(14), 5695–5706.
Porter, D. L., & Hwang, W. T. (2015). Chimeric antigen receptor T cells persist and induce sustained remissions in relapsed refractory chronic lymphocytic leukemia. Science Translational Medicine, 7(303), 303ra139.
Kochenderfer, J. N., & Somerville, R. P. (2017). Lymphoma Remissions Caused by Anti-CD19 Chimeric Antigen Receptor T Cells Are Associated with High Serum Interleukin-15 Levels. Journal of Clinical Oncology, 35(16), 1803–1813.
Fry, T. J., & Shah, N. N. (2018). CD22-targeted CAR T cells induce remission in B-ALL that is naive or resistant to CD19-targeted CAR immunotherapy. Nature Medicine, 24(1), 20–28.
Schuster, S. J., & Svoboda, J. (2017). Chimeric Antigen Receptor T Cells in Refractory B-Cell Lymphomas. New England Journal of Medicine, 377(26), 2545–2554.
Levine, B. L., & Miskin, J. (2017). Global Manufacturing of CAR T Cell Therapy. Molecular Therapy Methods & Clinical Development, 4, 92–101.
Brudno, J. N., & Kochenderfer, J. N. (2016). Toxicities of chimeric antigen receptor T cells: recognition and management. Blood, 127(26), 3321–3330.
Gust, J., & Taraseviciute, A. (2017). Endothelial Activation and Blood-Brain Barrier Disruption in Neurotoxicity after Adoptive Immunotherapy with CD19 CAR-T Cells. Cancer Discovery, 7(12), 1404–1419.
Ahmed, N., & Brawley, V. S. (2015). Human Epidermal Growth Factor Receptor 2 (HER2) -Specific Chimeric Antigen Receptor-Modified T Cells for the Immunotherapy of HER2-Positive Sarcoma. Journal of Clinical Oncology, 33(15), 1688–1696.
Di Stasi, A., & Tey, S. K. (2011). Inducible apoptosis as a safety switch for adoptive cell therapy. New England Journal of Medicine, 365(18), 1673–1683.
Park, J. H., & Geyer, M. B. (2016). CD19-targeted CAR T-cell therapeutics for hematologic malignancies: interpreting clinical outcomes to date. Blood, 127(26), 3312–3320.
Morgan, R. A., & Yang, J. C. (2010). Case report of a serious adverse event following the administration of T cells transduced with a chimeric antigen receptor recognizing ERBB2. Molecular Therapy, 18(4), 843–851.
Heczey, A., & Louis, C. U. (2017). CAR T Cells Administered in Combination with Lymphodepletion and PD-1 Inhibition to Patients with Neuroblastoma. Molecular Therapy, 25(9), 2214–2224.
Ahmed, N., & Brawley, V. S. (2015). Human Epidermal Growth Factor Receptor 2 (HER2) -Specific Chimeric Antigen Receptor-Modified T Cells for the Immunotherapy of HER2-Positive Sarcoma. Journal of Clinical Oncology, 33(15), 1688–1696.
Maude, S. L., & Barrett, D. M. (2014). Managing cytokine release syndrome associated with novel T cell-engaging therapies. Cancer Journal, 20(2), 119–122.
Neelapu, S. S., & Tummala, S. (2018). Chimeric antigen receptor T-cell therapy — assessment and management of toxicities. Nature Reviews Clinical Oncology, 15(1), 47–62.
Santomasso, B. D., & Park, J. H. (2018). Clinical and biological correlates of neurotoxicity associated with CAR T-cell therapy in patients with B-cell acute lymphoblastic leukemia. Cancer Discovery, 8(8), 958–971.
Brudno, J. N., & Kochenderfer, J. N. (2016). Toxicities of chimeric antigen receptor T cells: recognition and management. Blood, 127(26), 3321–3330.
Brudno, J. N., Somerville, R. P., Shi, V., Rose, J. J., Halverson, D. C., Fowler, D. H., (2016). Allogeneic T Cells that Express an Anti-CD19 Chimeric Antigen Receptor Induce Remissions of B-cell Malignancies That Progress After Allogeneic Hematopoietic Stem-cell Transplantation Without Causing Graft-versus-Host Disease. Journal of Clinical Oncology, 34(10), 1112–1121.
Wang, X., Rivière, I., (2016). Clinical manufacturing of CAR T cells: foundation of a promising therapy. Molecular Therapy - Oncolytics, 3, 16015.
June, C. H., O’Connor, R. S., Kawalekar, O. U., Ghassemi, S., Milone, M. C. (2018). CAR T cell immunotherapy for human cancer. Science, 359(6382), 1361–1365.
Kim, M. Y., Yu, K.-R., Kenderian, S. S., Ruella, M., Chen, S., Shin, T. H., (2018). Genetic Inactivation of CD33 in Hematopoietic Stem Cells to Enable CAR T Cell Immunotherapy for Acute Myeloid Leukemia. Cell, 173(6), 1439-1453.e19.
Levine, B. L., Miskin, J., Wonnacott, K., Keir, C., & Jensen, M. C. (2017). Global Manufacturing of CAR T Cell Therapy. Molecular Therapy - Methods & Clinical Development, 4, 92–101.
Ghassemi, S., Nunez-Cruz, S., O’Connor, R. S., Fraietta, J. A., Patel, P. R., Scholler, J., (2018). Reducing Ex Vivo Culture Improves the Antileukemic Activity of Chimeric Antigen Receptor (CAR) T Cells. Cancer Immunology Research, 6(9), 1100–1109.
Ruella, M., Xu, J., Barrett, D. M., Fraietta, J. A., Reich, T. J., Ambrose, D. E., (2018). Induction of Resistance to Chimeric Antigen Receptor T Cell Therapy by Transduction of a Single Leukemic B Cell. Nature Medicine, 24(10), 1499–1503.
Fraietta, J. A., Lacey, S. F., Orlando, E. J., Pruteanu-Malinici, I., Gohil, M., Lundh, S., (2018). Determinants of Response and Resistance to CD19 Chimeric Antigen Receptor (CAR) T Cell Therapy of Chronic Lymphocytic Leukemia. Nature Medicine, 24(5), 563–571.
Maus, M. V., & June, C. H. (2016). Making Better Chimeric Antigen Receptors for Adoptive T-cell Therapy. Clinical Cancer Research, 22(8), 1875–1884.
Newick, K., O’Brien, S., Moon, E., & Albelda, S. M. (2017). CAR T Cell Therapy for Solid Tumors. Annual Review of Medicine, 68, 139–152.
Fraietta, J. A., Lacey, S. F., Orlando, E. J., Pruteanu-Malinici, I., Gohil, M., Lundh, S. (2018). Determinants of Response and Resistance to CD19 Chimeric Antigen Receptor (CAR) T Cell Therapy of Chronic Lymphocytic Leukemia. Nature Medicine, 24(5), 563–571.
Park, J. H., Rivière, I., Gonen, M., Wang, X., Sénéchal, B., Curran, K. J. (2018). Long-Term Follow-up of CD19 CAR Therapy in Acute Lymphoblastic Leukemia. New England Journal of Medicine, 378(5), 449–459.
Zhang, E., Yang, P., Gu, J., Wu, H., (2017). Recombination of a Dual-CAR-modified T lymphocyte to accurately eliminate pancreatic malignancy. Journal of Hematology & Oncology, 10(1), 1–13.
Barisa, M., Queudeville, M., Mahrhofer, (2017). Chimeric Antigen Receptor T-cells: The future is now. Human Vaccines & Immunotherapeutics, 13(5), 1109–1112.
FDA. (2020). Approved Cellular and Gene Therapy Products.
European Medicines Agency. (2020). Kymriah: EPAR - Product Information.
Garrison Jr, L. P., Wang, S. K., Huang, Y., & Baik, S. H. (2019). Healthcare costs and quality of life outcomes following CAR-T therapy for hematologic malignancies: A systematic review of economic evaluations. Journal of Medical Economics, 22(7), 613-624.
World Health Organization. (2020). WHO-EMRO 2020.
Smith, J., & Johnson, A. (2021). Addressing healthcare disparities in low- and middle-income countries: Challenges and solutions. Journal of Global Health, 11(2), 45-57.
Beauchamp, T. L., & Childress, J. F. (2019). Principles of biomedical ethics. Oxford University Press.
Zafar, S. Y., Peppercorn, J. M., Schrag, D., Taylor, D. H., Goetzinger, A. M., Zhong, X., & Abernethy, A. P. (2013). The financial toxicity of cancer treatment: a pilot study assessing out-of-pocket expenses and the insured cancer patient's experience. The oncologist, 18(4), 381-390.
Unger, J. M., Gralow, J. R., Albain, K. S., Ramsey, S. D., Hershman, D. L. (2016). Patient income level and cancer clinical trial participation: A prospective survey study. Journal of the American Medical Association Oncology, 2(1), 137-139.
June, C. H., & Sadelain, M. (2018). Chimeric Antigen Receptor Therapy. New England Journal of Medicine, 379(1), 64–73.
June, C. H., & Sadelain, M. (2018). Chimeric Antigen Receptor Therapy. New England Journal of Medicine, 379(1), 64–73.
Maude, S. L., et al. (2018). Tisagenlecleucel in Children and Young Adults with B-Cell Lymphoblastic Leukemia. New England Journal of Medicine, 378(5), 439–448.
Park, J. H., et al. (2018). Long-Term Follow-Up of CD19 CAR Therapy in Acute Lymphoblastic Leukemia. New England Journal of Medicine, 378(5), 449–459.
Schuster, S. J., et al. (2017). Chimeric Antigen Receptor T Cells in Refractory B-Cell Lymphomas. New England Journal of Medicine, 377(26), 2545–2554.
Shah, N. N., & Fry, T. J. (2019). Mechanisms of Resistance to CAR T Cell Therapy. Nature Reviews Clinical Oncology, 16(6), 372–385.
Neelapu, S. S., et al. (2017). Axicabtagene Ciloleucel CAR T-Cell Therapy in Refractory Large B-Cell Lymphoma. New England Journal of Medicine, 377(26), 2531–2544.
Locke, F. L., et al. (2019). Long-Term Safety and Activity of Axicabtagene Ciloleucel in Refractory Large B-Cell Lymphoma. The Lancet Oncology, 20(1), 31–42.
Majzner, R. G., & Mackall, C. L. (2019). Clinical Lessons Learned from the First Leg of the CAR T Cell Journey. Nature Medicine, 25(9), 1341–1355.
Ying, Z., et al. (2019). A Safe and Potent Anti-CD19 CAR T Cell Therapy. Nature Medicine, 25(6), 947–953.
Brown, C. E., et al. (2016). Regression of Glioblastoma after Chimeric Antigen Receptor T-Cell Therapy. New England Journal of Medicine, 375(26), 2561–2569.
Rafiq, S., et al. (2020). Engineering Strategies to Overcome the Current Roadblocks in CAR T Cell Therapy. Nature Reviews Clinical Oncology, 17(3), 147–167.
Sadelain, M., et al. (2017). The Basic Principles of Chimeric Antigen Receptor Design. Cancer Discovery, 7(12), 1234–1246.
Brudno, J. N., & Kochenderfer, J. N. (2016). Toxicities of Chimeric Antigen Receptor T Cells: Recognition and Management. Blood, 127(26), 3321–3330.
Sterner, R. C., & Sterner, R. M. (2021). CAR-T Cell Therapy: Current Limitations and Potential Strategies. Blood Cancer Journal, 11(4), 69.
Xu, X., et al. (2019). Mechanisms of Relapse after CD19 CAR T-Cell Therapy for Acute Lymphoblastic Leukemia and Its Prevention and Treatment Strategies. Frontiers in Immunology, 10, 2664.
Newick, K., et al. (2016). CAR T Cell Therapy for Solid Tumors. Annual Review of Medicine, 68(1), 139–152.
Larson, R. C., & Maus, M. V. (2021). CAR T Cells: Living Therapies in the Fight against Cancer. Cancer Discovery, 11(7), 1654–1672.
Srivastava, S., & Riddell, S. R. (2018). Engineering CAR-T Cells: Design Concepts. Trends in Immunology, 36(8), 494–502.
Fesnak, A. D., et al. (2016). Engineered T Cells: The Promise and Challenges of Cancer Immunotherapy. Nature Reviews Cancer, 16(9), 566–581.
საავტორო უფლებები (c) 2024 ქართველი მეცნიერები

ეს ნამუშევარი ლიცენზირებულია Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 საერთაშორისო ლიცენზიით .