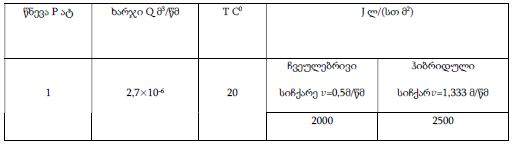
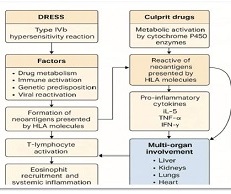
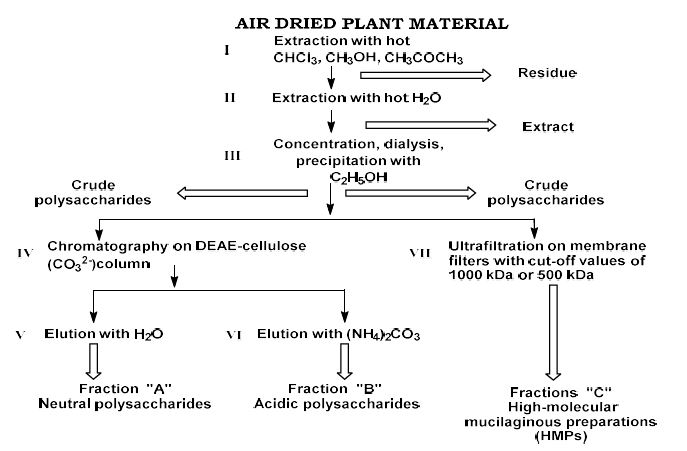
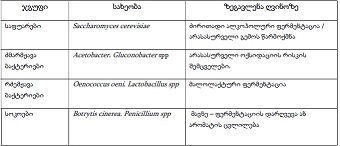
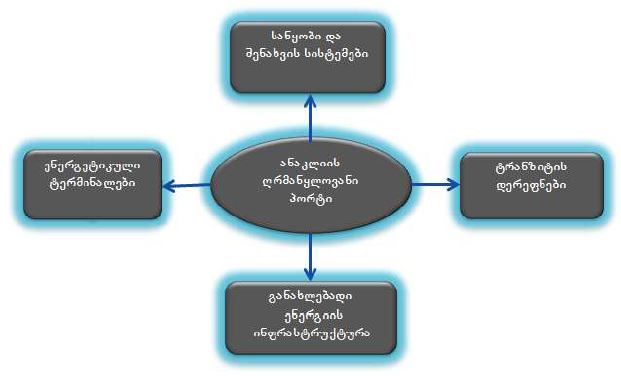
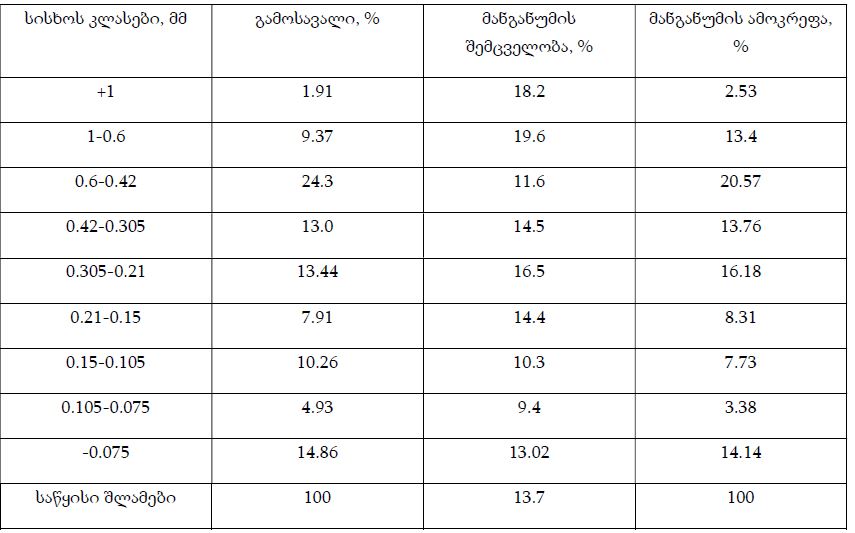
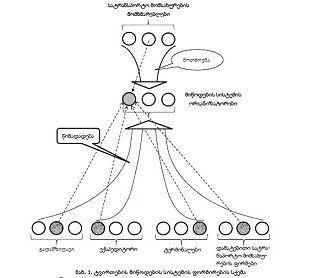
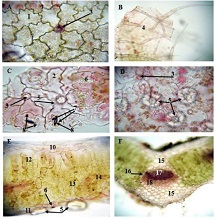
მიოფიბრილების ასაკობრივი ცლილებები სხვადასხვა ასაკის თეთრ ლაბორატორიულ ვირთაგვებში
ჩამოტვირთვები
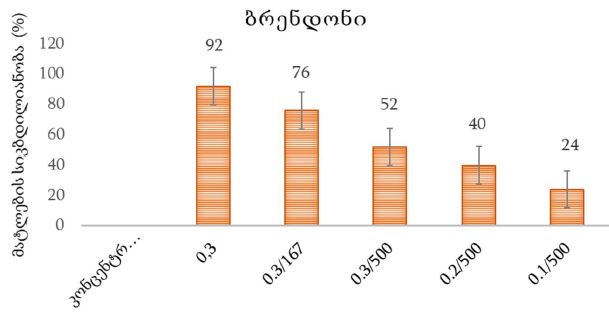
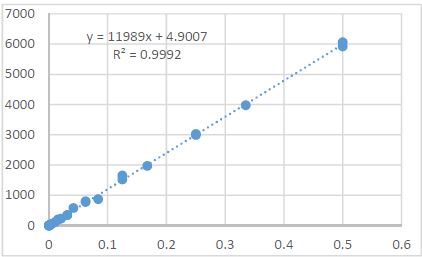
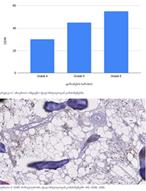
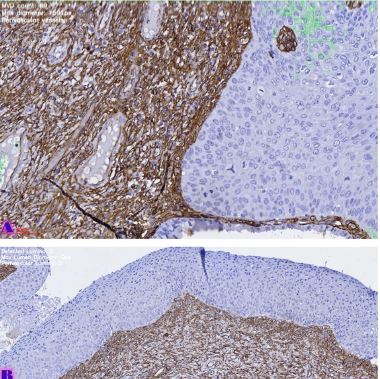
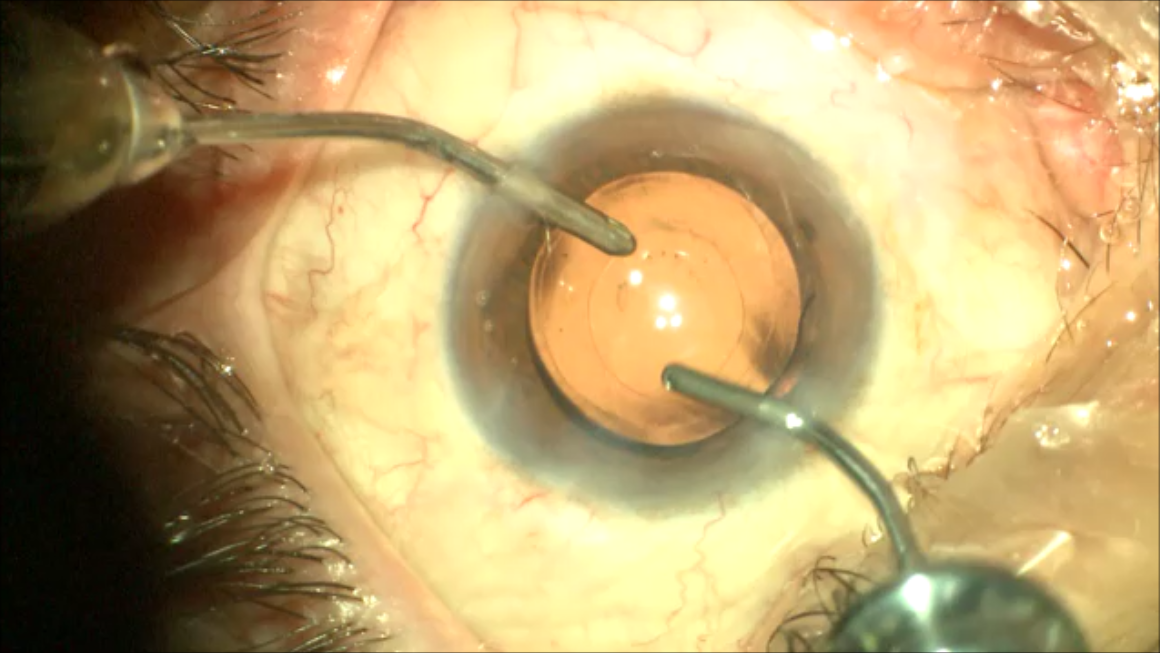
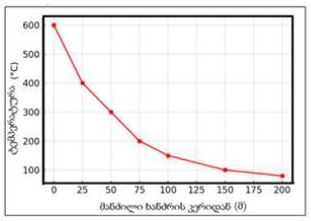
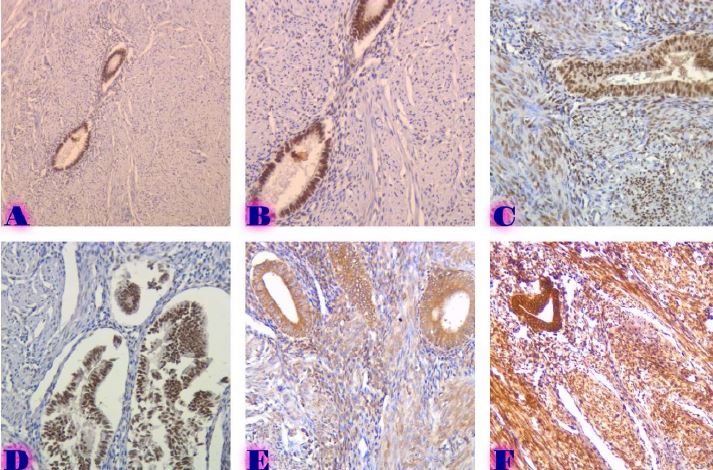
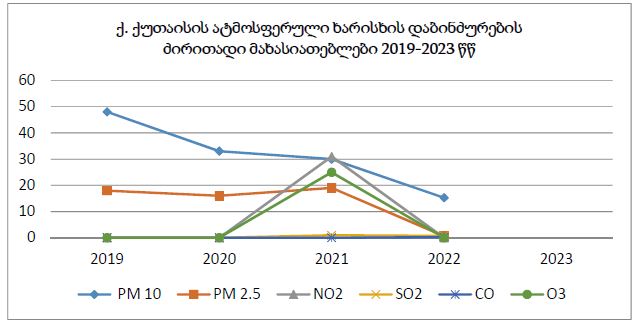
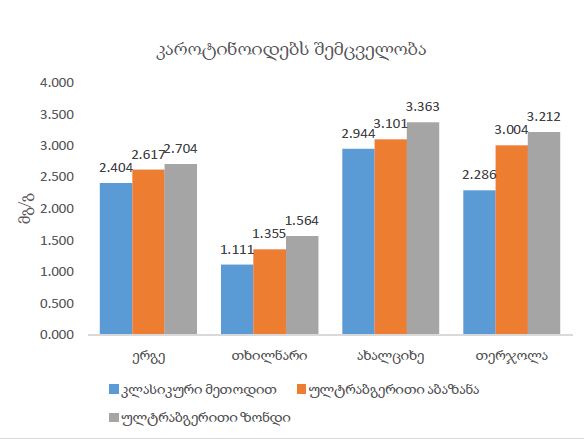
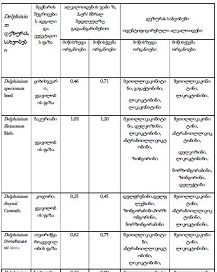
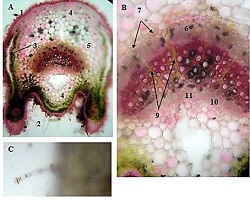
14 თვის და უფრო ხანდაზმული ექსპერიმენტული თეთრი ვირთაგვების გულის იზოლირებული პრეპარატების შესწავლა ცხადჰყოფს, რომ ხანდაზმული ასაკის ვირთაგვებში კარდიომიოციტების სიგრძივი ორიენტაცია იცვლება კუთხური ორიენტაციით. ასევე გასათვალისწინებელია ის ფაქტიც, რომ ასაკის მატებასთან ერთად იკლებს როგორც კარდიომიოციტების, ისე მიოციტში მიოფიბრილების რაოდენობა. გულის ისეთი პათოლოგიების აღმოცენება, როგორებიცაა გულის უკმარისობა დაქვეითებული განდევნის ფრაქციით, შეკუმშვის ძალისა და რითმის დარღვევები, შესაძლოა დიდწილად რეალიზდებოდნენ სწორედ უჯრედშიდა სტრუქტურების, კერძოდ მიოფიბრილების დონეზე. საინტერესოა მიოფიბრილებთან ერთად მიოციტის ციტოპლაზმის პროცენტული შემადგენლობის კვლევა ასაკობრივ ჭრილში, რაც კვლევას ხდის მეტად ვალიდურს და სახავს სამომავლო პერსპექტივას მისი გაგრძელებისთვის.
Downloads
Metrics
Barry, S. P., Davidson, S. M. & Townsend, P. A. Molecular regulation of cardiac hypertrophy. Int. J. Biochem. Cell Biol. 40, 2023–2039 (2008).Zhou Q, Li L,
Zhao B, Guan KL. The hippo pathway in heart development, regeneration, and diseases. Circ Res. 2015;116:1431–1447.
Yoshida M, et al. Weaving hypothesis of cardiomyocyte sarcomeres: discovery of periodic broadening and narrowing of intercalated disk during volume-load change. Am J Pathol. 2010;176:660–678.
Nepomnyashchy L. M. Morphgenesis of the major all-pathological processes in heart / L. M. Nepomnyashchy. — Novosibirsk : Science, 1991. — 349 p
Schmidt RE, Dorsey DA, Beaudet LN, et al. Experimental Rat Model: 10.1093/jnen/63.5.450
Ahmed HM. Blaha MJ. Nasir K. Rivera JJ. Blumenthal RS. Effects of physical activity on cardiovascular disease. Am J Cardiol. 2012;109:288–295.
Andersson DC. Fauconnier J. Yamada T. Lacampagne A. Zhang SJ. Katz A. Westerblad H. Mitochondrial production of reactive oxygen species contributes to the beta-adrenergic stimulation of mouse cardiomycytes. J Physiol. 2011;589:1791
Beer M. Seyfarth T. Sandstede J. Landschutz W. Lipke C. Kostler H. von Kienlin M. Harre K. Hahn D. Neubauer S. Absolute concentrations of high-energy phosphate metabolites in normal, hypertrophied, and failing human myocardium measured noninvasively with (31)P-SLOOP magnetic resonance spectroscopy. J Am Coll Cardiol. 2002;40:1267–1274.
Capasso JM, Strobeck JE, Sonnenblick EH: Myocardial mechanical alterations during gradual onset of long-term hypertension in rats. Am J Physiol 1981;241:H435-H441
Julian FJ, Morgan DL, Moss RL, Gonzales M, Dwivedi P: Myocyte growth without physiological impairment in grad- ually induced rat cardiac hypertrophy. Circ Res 1981; 49:1300
Meerson FZ, Javich MP, Lerman MI: Decrease in the rate of RNA and protein synthesis and degradation in the myocar- dium under long-term compensatory hyperfunction and on aging. J Mol Cell Cardiol 1978;10:145-149
Waterlow JC, Garlick PJ, Millward DJ: Protein Turnoverin Mammalian Tissues and in the Whole Body. North-Holland, Amsterdam/New York/Oxford, 1978
Ram R, Mickelsen DM, Theodoropoulos C, Blaxall BC. New approaches in small animal echocardiography: imaging the sounds of silence. Am J Physiol Heart Circ Physiol. 2011;301:H1765–80
Stuckey DJ, Carr CA, Tyler DJ, Clarke K. Cine-MRI versus two-dimensional echocardiography to measure in vivo left ventricular function in rat heart. NMR Biomed. 2008;21:765
Hanft LM, Greaser ML, McDonald KS. Titin-mediated control of cardiac myofibrillar function. Archives of Biochemistry and Biophysics. 2014;552–553
Herron TJ, Korte FS, McDonald KS. Power output is increased after phosphorylation of myofibrillar proteins in rat skinned cardiac myocytes. Circulation Research. 2001;89:1184
Korte FS, McDonald KS. Sarcomere length dependence of rat skinned cardiac myocyte mechanical properties: dependence on myosin heavy chain. Journal of Physiology. 2007;581
Mun JY, Gulick J, Robbins J, Woodhead J, Lehman W, Craig R. Electron microscopy and 3D reconstruction of F-actin decorated with cardiac myosin-binding C (cMyBP-C) Journal of Molecular Biology. 2011;410:214
Previs MJ, Beck Previs S, Gulick J, Robbins J, Warshaw DM. Molecular mechanics of cardiac myosin-binding protein C in native thick filaments. Science. 2012;337
Regnier M, Martin H, Barsotti RJ, Rivera AJ, Martyn DA, Clemmons E. Cross-bridge versus thin filament contributions to the level and rate of force development in cardiac muscle. Biophysical Journal. 2004;87:1815
Korte FS, Herron TJ, Rovetto MJ, McDonald KS. Power output is linearly related to MyHC content in rat myocytes and isolated working hearts. American Journal of Physiology. 2005;289:H80

ეს ნამუშევარი ლიცენზირებულია Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 საერთაშორისო ლიცენზიით .