TGF-β რეფრაქტერული იმუნური თრომბოციტოპენის მქონე პაციენტებში
ჩამოტვირთვები
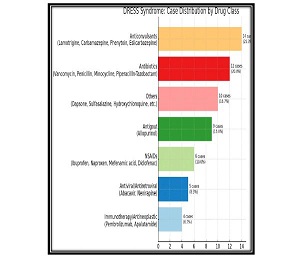
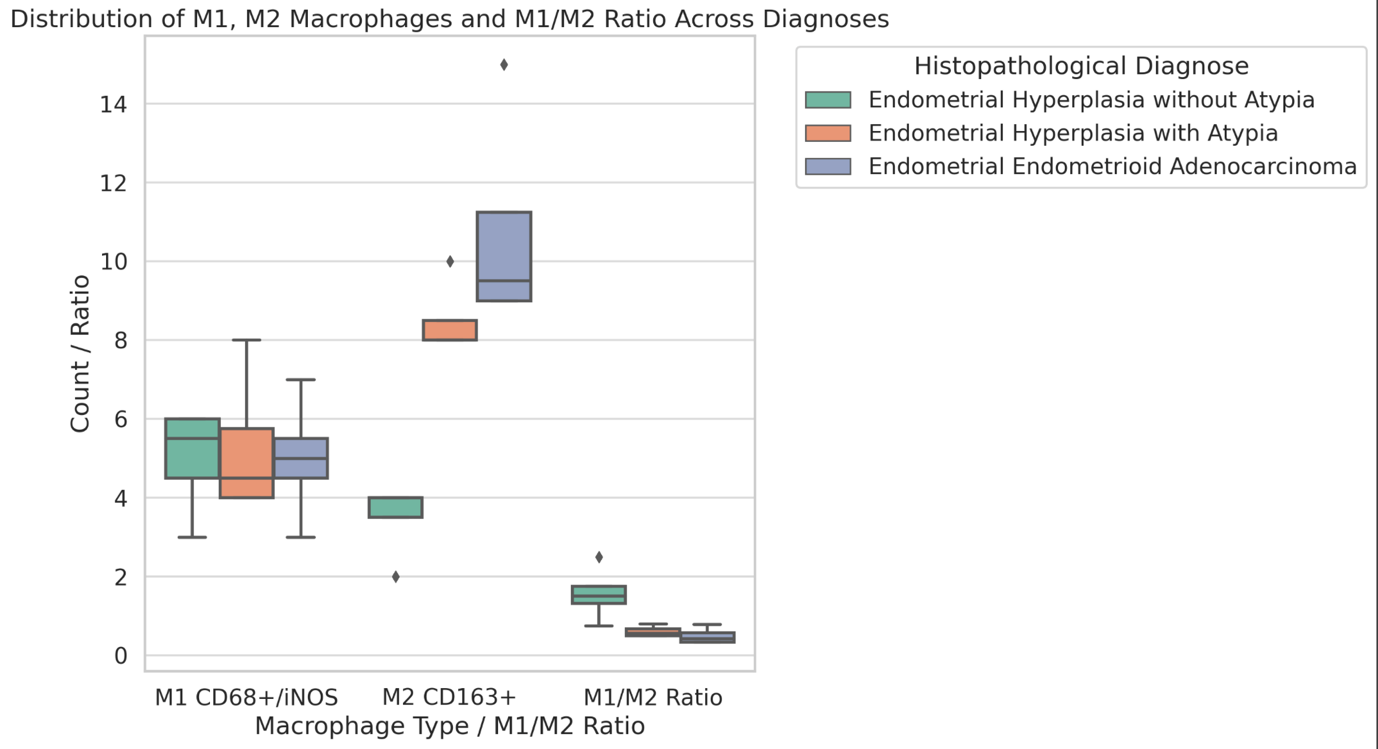
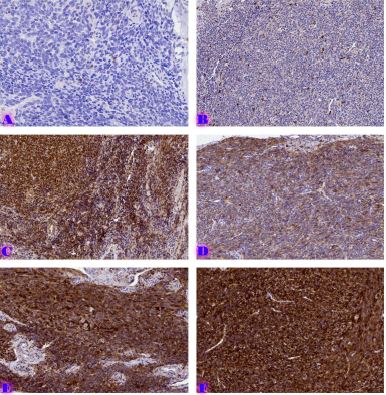
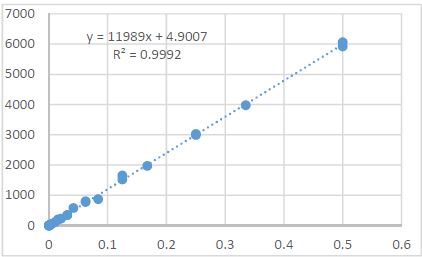
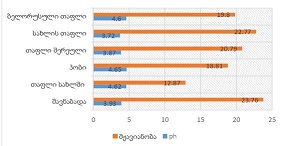
იმუნური თრომბოციტოპენია (ითპ, ასევე, იდიოპათიური თრომბოციტოპენიური პურპურა) წარმოადგენს შეძენილ თრომბოციტოპენიას, რომელიც ხასიათდება თრომბოციტების რაოდენობის შემცირებით (<100 მიკრო/ლ), რაც განპირობებულია აუტოანტისხეულების მიერ თრომბოციტების დესტრუქციით [1] . ყოველწლიურად 100,000 მოზრდილში 2,6-6,6 ითპ-ს შემთხვევა აღიწერება [2][3]. ითპ-ის პათოგენეზში წამყვანი როლი თრომბოციტების მემბრანის გლიკოპროტეინი GPIIბ/IIIა-ს წინააღმდეგ მიმართულ აუტოანტისხეულებს ენიჭება [4], ხოლო დაავადების მიმდინარეობასა და მის კლინიკურ გამოსავალში კარდინალური მნიშვნელობა აქვს ანთებითი და იმუნოსუპრესორული მედიატორების ბალანსს. მათგან ბოლოდროინდელი კვლევების ფოკუსში მოექცა T-უჯრედები და მათი პროდუქტები - ციტოკინები და ქემოკინები, რომლებიც იმუნურ ნიშებში უჯრედ-უჯრედული ურთიერთქმედების მიკროგარემოს აყალიბებენ [5]. მიმდინარე კვლევებით დასტურდება მარეგულირებელი T უჯრედების (Treg) მნიშვნელობა ითპ პათოგენეზში რომელთა ფუნქციასა და აქტივაციაში დიდი როლი მატრანსფორმირებელ ზრდის ფაქტორ ბეტას (TGF-β) ენიჭებაა [6].TGF-β წარმოადგენს მრავალფუნქციურ ციტოკენების ოჯახს, რომელიც მონაწილეობს სხვადასხვა უჯრედის პროლიფერაციაში, დიფერენციაციაში, ადჰეზიასა და მიგრაციაში. განარჩევენ TGF-β-ს სამ ფორმას, TGF-β1, TGF-β2 და TGF-β3. [7] რომელთაგან TGF-β1 განსაკუთრბით მნიშვნელოვანია იმუნური სისტემის ბალანსში. [8] TGF-β-ს გავლენით, ერთი მხრივ, ხდება CD4+ T ლიმფოციტების ეფექტორულ Th1 და Th2 უჯრედებად დიფერენცირების დათრგუნვა [9][10], მეორე მხრივ კი აქტიურდება Treg უჯრედების წარმოქმნა [11][12].მიუხედავად იმისა, რომ TGF-β-ს სასიგნალო გზა ბოლომდე შესწავლილი არ არის, ცნობილია მისი როლი სხვადასხვა აუტოიმუნური და ანთებითი დაავადების პათოგენეზში [11][13][14]. თუმცა, ჯერ კიდევ მწირია იმფორმაცია TGF-β როლის შესახებ იმუნური თრომბოციტოპენიის მქონე პაციენტებში. Zheng-Ju Zhou et al. კვლევაში TGF-β დონე მნიშვნელოვნად განსხვავდება ითპ-პაციენტების პერიპერიულ სისხლში საკონტროლო ჯგუფთან შედარებით, ამავე კვლევაში საყურადღებოა TGF-β დადებითი კორელაცია თრომბოციტებთან პერიფერიულ სისხლში [15]. წინამდებარე კვლევის მიზანს წარმოადგენდა TGF-β-ის დონის განსაზღვრა ითპ-ს მქონე იმ პაციენტებში, რომლებსაც კორტიკოსტეროიდებზე რეზისტენტობის გამო ჩაუტარდათ სპლენექტომია, როგორც მეორე რიგის თერაპია, ასევე, მისი კორელაციის დადგენა სისტემური ანთების სისხლის ბიომარკერებთან.
Downloads
D. Nugent, R. McMillan, J. L. Nichol, and S. J. Slichter, “Pathogenesis of chronic immune thrombocytopenia: Increased platelet destruction and/or decreased platelet production,” Br. J. Haematol., vol. 146, no. 6, pp. 585–596, 2009, doi: 10.1111/j.1365-2141.2009.07717.x.
H. Frederiksen and K. Schmidt, “The incidence of idiopathic thrombocytopenic purpura in adults increases with age,” Blood, vol. 94, no. 3, pp. 909–913, 1999, doi: 10.1182/blood.v94.3.909.415k02_909_913.
J. B. Segal and N. R. Powe, “Prevalence of immune thrombocytopenia: Analyses of administrative data,” J. Thromb. Haemost., vol. 4, no. 11, pp. 2377–2383, 2006, doi: 10.1111/j.1538-7836.2006.02147.x.
S. Audia et al., “Splenic TFH expansion participates in B-cell differentiation and antiplatelet-antibody production during immune thrombocytopenia,” Blood, vol. 124, no. 18, pp. 2858–2866, 2014, doi: 10.1182/blood-2014-03-563445.
S. Audia, M. Mahévas, M. Samson, B. Godeau, and B. Bonnotte, “Pathogenesis of immune thrombocytopenia,” Autoimmun. Rev., vol. 16, no. 6, pp. 620–632, 2017, doi: 10.1016/j.autrev.2017.04.012.
J. A. Turner et al., “Regulatory T Cell-Derived TGF-β1 Controls Multiple Checkpoints Governing Allergy and Autoimmunity,” Immunity, vol. 53, no. 6, pp. 1202-1214.e6, Dec. 2020, doi: 10.1016/j.immuni.2020.10.002.
G. C. Blobe, W. P. Schiemann, and H. F. Lodish, “Role of Transforming Growth Factor β in Human Disease,” New England Journal of Medicine, vol. 342, no. 18. pp. 1350–1358, 2000, doi: 10.1056/nejm200005043421807.
J. P. Annes, J. S. Munger, and D. B. Rifkin, “Making sense of latent TGFbeta activation,” J. Cell Sci., vol. 116, no. Pt 2, pp. 217–224, Jan. 2003, doi: 10.1242/JCS.00229.
L. Gorelik, P. E. Fields, and R. A. Flavell, “Cutting Edge: TGF-β Inhibits Th Type 2 Development Through Inhibition of GATA-3 Expression,” J. Immunol., vol. 165, no. 9, pp. 4773–4777, Nov. 2000, doi: 10.4049/JIMMUNOL.165.9.4773.
J. T. Lin, S. L. Martin, L. Xia, and J. D. Gorham, “TGF-β1 Uses Distinct Mechanisms to Inhibit IFN-γ Expression in CD4+ T Cells at Priming and at Recall: Differential Involvement of Stat4 and T-bet,” J. Immunol., vol. 174, no. 10, pp. 5950–5958, May 2005, doi: 10.4049/JIMMUNOL.174.10.5950.
S. Sanjabi, S. A. Oh, and M. O. Li, “Regulation of the Immune Response by TGF-β: From Conception to Autoimmunity and Infection,” Cold Spring Harb. Perspect. Biol., vol. 9, no. 6, p. a022236, Jun. 2017, doi: 10.1101/CSHPERSPECT.A022236.
M. G. Strainic, E. M. Shevach, F. An, F. Lin, and M. E. Medof, “Absence of signaling into CD4+ cells via C3aR and C5aR enables autoinductive TGF-β1 signaling and induction of Foxp3+ regulatory T cells,” Nat. Immunol., vol. 14, no. 2, pp. 162–171, Feb. 2013, doi: 10.1038/NI.2499.
J. J. Letterio and A. B. Roberts, “REGULATION OF IMMUNE RESPONSES BY TGF-β*,” http://dx.doi.org/10.1146/annurev.immunol.16.1.137, vol. 16, pp. 137–161, Nov. 2003, doi: 10.1146/ANNUREV.IMMUNOL.16.1.137.
K. Nakamura et al., “TGF-β1 Plays an Important Role in the Mechanism of CD4+CD25+ Regulatory T Cell Activity in Both Humans and Mice,” J. Immunol., vol. 172, no. 2, pp. 834–842, Jan. 2004, doi: 10.4049/JIMMUNOL.172.2.834.
Z. J. Zhou, Y. S. Zhang, C. X. Liang, and Z. Y. Yang, “Role of Th9, Th17, Treg Cells levels and IL-9, IL-17 and TGF-β Expression in Peripheral Blood of Patients with ITP in Pathogenesis of ITP,” Zhongguo shi yan xue ye xue za zhi, vol. 27, no. 1, pp. 180–184, 2019, doi: 10.7534/j.issn.1009-2137.2019.01.029.
S. Metreveli, I. Kvachadze, N. Kikodze, T. Chikovani, and N. Janikashvili, “PERIPHERIAL BLOOD BIOMARKERS IN PATIENTS WITH REFRACTORY IMMUNE THROMBOCYTOPENIA.,” Georgian Med. News, no. 302, pp. 45–49, May 2020, Accessed: Sep. 27, 2022. [Online]. Available: https://europepmc.org/article/med/32672688.
L. Gorelik, S. Constant, and R. A. Flavell, “Mechanism of Transforming Growth Factor  – induced Inhibition of T Helper Type 1 Differentiation,” vol. 195, no. 11, pp. 0–6, 2002, doi: 10.1084/jem.20012076.
S. Yamagiwa, J. D. Gray, S. Hashimoto, and D. A. Horwitz, “A Role for TGF-β in the Generation and Expansion of CD4+CD25+ Regulatory T Cells from Human Peripheral Blood,” J. Immunol., vol. 166, no. 12, pp. 7282–7289, Jun. 2001, doi: 10.4049/JIMMUNOL.166.12.7282.
R. Shanmugasundaram and R. K. Selvaraj, “In vitro human TGF-β treatment converts CD4+CD25− T cells into induced T regulatory like cells,” Vet. Immunol. Immunopathol., vol. 137, no. 1–2, pp. 161–165, Sep. 2010, doi: 10.1016/J.VETIMM.2010.04.017.
J. B. Allen, C. L. Manthey, A. R. Hand, K. Ohura, L. Ellingsworth, and S. M. Wahl, “Rapid onset synovial inflammation and hyperplasia induced by transforming growth factor beta,” J. Exp. Med., vol. 171, no. 1, p. 231, Jan. 1990, doi: 10.1084/JEM.171.1.231.
S. M. Wahl, J. B. Allen, G. L. Costa, H. L. Wong, and J. R. Dasch, “Reversal of acute and chronic synovial inflammation by anti-transformlng growth factor β,” J. Exp. Med., vol. 177, no. 1, pp. 225–230, 1993, doi: 10.1084/jem.177.1.225.
A. P. Kuruvilla, R. Shah, G. M. Hochwald, H. D. Liggitt, M. A. Palladino, and G. J. Thorbecke, “Protective effect of transforming growth factor beta 1 on experimental autoimmune diseases in mice.,” Proc. Natl. Acad. Sci. U. S. A., vol. 88, no. 7, p. 2918, Apr. 1991, doi: 10.1073/PNAS.88.7.2918.
G. J. Thorbecke, R. Shah, C. H. Leu, A. P. Kuruvilla, A. M. Hardison, and M. A. Palladino, “Involvement of endogenous tumor necrosis factor alpha and transforming growth factor beta during induction of collagen type II arthritis in mice,” Proc. Natl. Acad. Sci. U. S. A., vol. 89, no. 16, pp. 7375–7379, 1992, doi: 10.1073/PNAS.89.16.7375.
E. Raz et al., “Modulation of disease activity in murine systemic lupus erythematosus by cytokine gene delivery,” Lupus, vol. 4, no. 4, pp. 286–292, 1995, doi: 10.1177/096120339500400409.
K. Ohtsuka, J. D. Gray, M. M. Stimmler, and D. A. Horwitz, “The relationship between defects in lymphocyte production of transforming growth factor-beta1 in systemic lupus erythematosus and disease activity or severity,” Lupus, vol. 8, no. 2, pp. 90–94, 1999, doi: 10.1191/096120399678847489.
საავტორო უფლებები (c) 2022 Sophio Metreveli , Nino Nanava , Irine Kvachadze, Tinatini Chikovani, Nona Janikashvili

ეს ნამუშევარი ლიცენზირებულია Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 საერთაშორისო ლიცენზიით .